题目内容
8.燃烧某有机物只生成88g二氧化碳和27g水,下列说法正确的是( )| A. | 该有机物的化学式为C3H8 | B. | 该有机物分子中一定含有碳碳双键 | ||
| C. | 该有机物不可能是乙烯 | D. | 该有机物一定含有氧元素 |
分析 燃烧某有机物只生成二氧化碳8.8g和水2.7g,二氧化碳物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,由原子守恒可知该有机物分子中C、H原子数目之比为0.2mol:0.15mol×2=2:3,不能确定有机物是否含有氧元素,若为烃时,该有机物可能为C4H6等,据此判断.
解答 解:燃烧某有机物只生成二氧化碳8.8g和水2.7g,二氧化碳物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,由原子守恒可知该有机物分子中C、H原子数目之比为0.2mol:0.15mol×2=2:3.
A.不能确定有机物是否含有氧元素,且分子中C、H原子数目之比不是3:8,故A错误;
B.若为烃时,该有机物可能为C4H6,可能含有2个碳碳双键,也可以含有碳碳三键等,故B错误;
C.该有机物物质C、H原子数目之比为2:3,不可能为乙烯,故C正确;
D.不能确定有机物是否含有氧元素,若知道有机物的质量可以确定是否含有氧元素,故D错误.
故选:C.
点评 本题考查有机物分子式确定计算,侧重对质量守恒定律的考查,注意最简式中H原子数目饱和碳的四价结构时,最简式即为分子式.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
16.如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式等化学用语填空回答以下问题:
(1)在③~⑦中元素,原子半径最大的是Na,⑤其离子的结构示意图为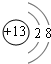 ,非金属性最强的是F.
,非金属性最强的是F.
(2)①~⑩中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;氢化物最稳定的是HF.
(3)按要求写出下列两种物质的电子式:⑥的氢化物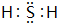 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸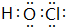 ;
;
(4)在⑦与⑩对应的两种单质中,化学性质较活泼的是Cl2,可用什么化学反应证明明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ,非金属性最强的是F.
,非金属性最强的是F.(2)①~⑩中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;氢化物最稳定的是HF.
(3)按要求写出下列两种物质的电子式:⑥的氢化物
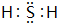 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸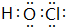 ;
;(4)在⑦与⑩对应的两种单质中,化学性质较活泼的是Cl2,可用什么化学反应证明明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
13.下列各组粒子中属于同位素的是( )
| A. | H2和D2 | B. | 白磷和红磷 | C. | 16O和18O | D. | 24Mg和24Na |
17.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
18.下列说法正确的是( )
| A. | 石油裂解目的是为了提高轻质油产量和质量 | |
| B. | 淀粉、纤维素、油脂都是高分子化合物 | |
| C. | 可以通过分液的方法分离乙酸乙酯和水的混合物 | |
| D. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 |
 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性. .
.
 (制酚醛树脂)④
(制酚醛树脂)④ (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)