题目内容
17.下列反应的离子方程式书写正确的是( )| A. | 碳酸钙与稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
分析 A.碳酸钙在离子反应中保留化学式;
B.生成的HClO在离子反应中保留化学式;
C.漏写生成硫酸钡的离子反应;
D.反应生成氯化铜、氯化亚铁,遵循电子、电荷守恒.
解答 解:A.碳酸钙与稀盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故A错误;
B.氯气与水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.氢氧化钡溶液与稀硫酸反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.氯化铁溶液与铜反应的离子反应为2Fe3++Cu═2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
4.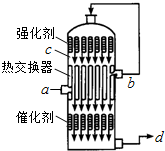 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )| A. | a、b两处的混合气体成分含量相同,温度不同 | |
| B. | c、d两处的混合气体成分含量相同,温度不同 | |
| C. | 热交换器的作用是预热待反应的气体,冷却反应后的气体 | |
| D. | c处气体经热交换后再次催化氧化的目的是提高SO2的转化率 |
8.燃烧某有机物只生成88g二氧化碳和27g水,下列说法正确的是( )
| A. | 该有机物的化学式为C3H8 | B. | 该有机物分子中一定含有碳碳双键 | ||
| C. | 该有机物不可能是乙烯 | D. | 该有机物一定含有氧元素 |
12.下列叙述正确的是( )
| A. | 卤素的氢化物中沸点最低的是HF | |
| B. | 因为H2O分子间有氢键,所以H2O比H2S稳定 | |
| C. | 一个X原子的质量为ag,则X元素的相对原子质量为aNA | |
| D. | 熔沸点:NH3<PCl3 |
2. 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )| A. | SO2(NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
9.在下列环境中,铁制品最容易生锈的是( )
| A. | 放在纯净的氧气中 | B. | 放在干燥的空气中 | ||
| C. | 放在潮湿的空气中 | D. | 浸没在蒸馏水中 |
6.下列不属于有机物的是( )
| A. |  | B. | S=C=S | C. | CCl4 | D. | HCOOH |
7.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原于核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素的电离能数据如下表; D元素的电负性是同周期元素中最大的; F原子最外层电子数与B的相同,其余各层均充满电子.
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为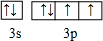 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为
 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.