题目内容
下列事实的解释正确的是( )
| A、将SO2、SO3 混合气体通入氯化钡溶液中,出现浑浊是因为生成了BaSO4沉淀 | ||||
| B、SO2通入溴水中,溴水褪色,是因为SO2的漂白性 | ||||
C、反应2C+SiO2
| ||||
| D、在NaHCO3的溶液中滴加NaAlO2溶液中有白色沉淀生成,是因为二者发生完全水解反应 |
考点:二氧化硫的化学性质,硅和二氧化硅
专题:氧族元素,碳族元素
分析:A.SO2与氯化钡不反应;
B.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr;
C.反应2C+SiO2
Si+2CO,为非自发氧化还原反应;
D.NaHCO3的溶液中滴加NaAlO2溶液,NaAlO2促进HCO3-的电离.
B.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr;
C.反应2C+SiO2
| ||
D.NaHCO3的溶液中滴加NaAlO2溶液,NaAlO2促进HCO3-的电离.
解答:
解:A.SO2与氯化钡不反应,SO3与氯化钡溶液中,出现浑浊,是因为生成了BaSO4沉淀不能生成沉淀,故A正确;
B.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr,与二氧化硫的还原性有关,与漂白性无关,故B错误;
C.碳的非金属性强于硅的非金属性,而反应2C+SiO2
Si+2CO,为非自发的氧化还原反应,不能比较非金属性,故C错误;
D.NaHCO3的溶液中滴加NaAlO2溶液,NaAlO2促进HCO3-的电离,则生成氢氧化铝沉淀,故D错误;
故选A.
B.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr,与二氧化硫的还原性有关,与漂白性无关,故B错误;
C.碳的非金属性强于硅的非金属性,而反应2C+SiO2
| ||
D.NaHCO3的溶液中滴加NaAlO2溶液,NaAlO2促进HCO3-的电离,则生成氢氧化铝沉淀,故D错误;
故选A.
点评:本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与应用能力的考查,选项C为解答的易错点,题目难度不大.

练习册系列答案
相关题目
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )


| A、平衡时X、Y的转化率相同 |
| B、该反应的化学方程式为:X(g)+Y(g)?2Z(g) |
| C、T℃时,若起始时X为2.00 mol,Y为2.00 mol,达平衡时Y的体积分数与原平衡Y的体积分数相同 |
| D、达到平衡后,将容器体积扩大为4L,平衡向逆反应方向移动 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系.下列有关物质的推断不正确的是( )
甲
乙
丙.
甲
| 丁 |
| 丁 |
| 甲 |
| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为AlCl3,则丁可能是NaOH溶液 |
| C、若甲为Fe,则丁可能是Cl2 |
| D、若甲为NaOH溶液,则丁可能是CO2 |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O═NaBO2+4H2↑.下列说法中正确的是( )
| A、被氧化的元素与被还原的元素质量比为1:4 |
| B、NaBH4既是氧化剂又是还原剂 |
| C、NaBH4是还原剂,H2O是氧化剂 |
| D、硼元素被氧化,氢元素被还原 |
已知某温度下,在100mL浓度为0.01mol/L的NaHB强电解质溶液中,c(H+)>(OH-),则下列关系式一定正确的是( )
| A、溶液的pH=2 |
| B、c(Na+)=0.01 mol/L≥c(B2-) |
| C、c (H+)?c(OH-)=10-14 |
| D、c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-) |
化合物A是一种新型杀虫剂,结构简式如图.则下列说法正确的是( )
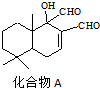

| A、化合物A分子中含有手性碳原子 |
| B、1mol化合物A与H2加成时最多可消耗1mol H2 |
| C、化合物A分子中所有碳原子共平面 |
| D、化合物A在浓硫酸作用下加热可发生消去反应 |