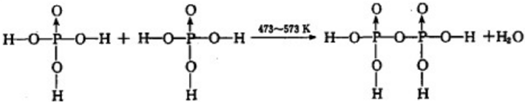
题目内容
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O═NaBO2+4H2↑.下列说法中正确的是( )
| A、被氧化的元素与被还原的元素质量比为1:4 |
| B、NaBH4既是氧化剂又是还原剂 |
| C、NaBH4是还原剂,H2O是氧化剂 |
| D、硼元素被氧化,氢元素被还原 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:在NaBH4+2H2O=NaBO2+4H2↑反应中,NaBH4中H元素的化合价为-1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂.
解答:
解:A.反应中B元素的化合价没有发生变化,反应中氧化剂和还原剂中化合价变化的数值相等,则被氧化的元素与被还原的元素质量比为1:1,故A错误;
B.NaBH4是还原剂,故B错误;
C.NaBH4中H元素的化合价为-1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂,故C正确;
D.B元素的化合价没有发生变化,只有H元素的化合价变化,故D错误;
故选C.
B.NaBH4是还原剂,故B错误;
C.NaBH4中H元素的化合价为-1价,H2O中H元素的化合价为+1价,二者发生氧化还原反应,其中NaBH4是还原剂,H2O是氧化剂,故C正确;
D.B元素的化合价没有发生变化,只有H元素的化合价变化,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从化合价角度分析解答,题目难度不大.

练习册系列答案
相关题目
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式不正确的是( )
A、CH3OH(l)+
| ||
| B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-1452KJ?mol-1 | ||
| C、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+725.8KJ?mol-1 | ||
| D、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=+1452KJ?mol-1 |
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )
| A、分子中N-C1键键长比CCl4分子中C-C1键键长长 |
| B、分子中的所有原于均达到8电子稳定结构 |
| C、NCl3分子是非极性分子 |
| D、NBr3比NCl3易挥发 |
下列事实的解释正确的是( )
| A、将SO2、SO3 混合气体通入氯化钡溶液中,出现浑浊是因为生成了BaSO4沉淀 | ||||
| B、SO2通入溴水中,溴水褪色,是因为SO2的漂白性 | ||||
C、反应2C+SiO2
| ||||
| D、在NaHCO3的溶液中滴加NaAlO2溶液中有白色沉淀生成,是因为二者发生完全水解反应 |