题目内容
6.第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1mol水蒸气放出热量569.1kJ.则该反应的热化学方程式为C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5 121.9 kJ•mol-1.
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图1,其总反应式为H2+2NiOOH$?_{放电}^{充电}$2Ni(OH)2.根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH增大(填“增大”、“减小”或“不变”),该电极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-
(3)Cu2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应式为2CLl-H20=CLl20+H2,阴极的电极反应式是2H++2e-=H2↑.用镍氢电池作为电源进行电解,当电池中有1mol H2被消耗时,Cu2O的理论产量为144g.
(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀.为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的负(填“正”或“负”)极相连.

分析 (1)辛烷C8H18燃烧生成1mol水蒸气时放热569.1KJ,据此计算1mol辛烷燃烧放热多少,再来书写热化学方程式;
(2)混合动力车上坡或加速时,是原电池中,正极发得电子发生还原反应,NiOOH得电子生成Ni(OH)2,同时生成氢氧根离子,溶液的pH变化增大;
(3)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,可以利用原电池原理牺牲阳极的阴极保护法进行保护;在电解池中,阴极是被保护的电极,可以采用外加电源的阴极保护法进行保护.
解答 解:(1)辛烷C8H18燃烧生成1mol水蒸气时放热569.1KJ,1mol辛烷燃烧生成9mol水,所以1mol辛烷燃烧放热放热569.1KJ×9=5 121.9 kJ,其热化学方程式为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5 121.9 kJ•mol-1,
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5 121.9 kJ•mol-1;
(2)混合动力车上坡或加速时,是原电池中,乙极是正极,得电子发生还原反应,NiOOH得电子生成Ni(OH)2,同时生成氢氧根离子,溶液的pH变化增大,故答案为:增大;NiOOH+H2O+e-═Ni(OH)2+OH-;
(3)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2,Cu2O的生成量为1mol,质量为144g,
故答案为:2H++2e-=H2↑;144.
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,可以利用原电池原理牺牲阳极的阴极保护法进行保护;在电解池中,阴极是被保护的电极,可以把船体与浸在海水里的Zn块相连,并与电源的负极相连,
故答案为:负.
点评 本题考查学生有关电化学和热化学的知识,注意热化学方程式书写和电极反应式书写,综合性较强,难度中等.

| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

(1)分别写出反应①、③、④的离子方程式:①Cr2O72-+3Zn+14H+=2Cr3++3Zn2++7H2O、③Cr(OH)3+OH-=CrO2-+2H2O、④2CrO2-+3H2O2+2OH-=2CrO42-+4H2O
(2)结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液.
(3)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(4)将KCl和CrCl3两种固体混合物共熔制得化合物X.将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O.另取0.0035mol X溶于水中,当加入0.0385mol Ag NO3时,恰好沉淀完全.则表示X组成的化学式为K5Cr2Cl11.
(1)已知:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能(KJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达到平衡的是BCEF(填选项字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、H2O(g)与CO2(g)的生成速率之比为1:1 D、该反应的平衡常数保持不变
E、混合气体的平均相对分子质量不变 F、容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制图1:
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
①催化剂效果最佳的反应是反应Ⅰ(填“反应Ⅰ”、“反应Ⅱ”、“反应Ⅲ”)
②T3的b点v(正)>v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是该反应为放热反应,温度升高,平衡逆向移动.
④在温度为T5时,该反应的平衡常数K=$\frac{100}{27}$.
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如图2所示.
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在t2时达到平衡.
请在图2 中画出t1时刻后CH3OH的浓度变化总趋势曲线.

| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
| A. | 平衡时容器内的压强是原来的0.8倍 | |
| B. | M的平均反应速率为0.15 mol•L-1•min-1 | |
| C. | x的值为1 | |
| D. | 平衡时P的浓度为0.25 mol•L-1 |
| A. | 增加酱油的鲜味 | B. | 预防缺铁性贫血病 | ||
| C. | 补充人体需要的铁元素 |
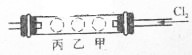 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是: