题目内容
1. NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.(1)铵态氮肥NH4NO3不能(填“能”或“不能”)与草木灰混合施用,用盐类水解的知识简述原因草木灰(K2CO3)水解显碱性,会产生大量氢氧根,NH4++OH-═NH3+H2O,把NH4NO3中的部分NH4+变成氨气,降低肥效.
(2)NH4NO3受热分解温度不同,分解产物也不同.在185~200°C时,NH4NO3分解生成笑气(N2O)和水,分解生成的氧化产物与还原产物的质量比为1:1.超过400°C,NH4NO3剧烈分解生成N2、NO2和H2O,并发生爆炸,若32g NH4NO3爆炸放出12.3kJ的热量,则NH4NO3分解爆炸的热化学方程式为4NH4NO3(s)=3N2(g)+2NO2(g)+8H2O(g)△H=-123kJ/mol.
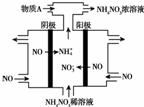
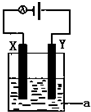
(3)电解NO制备 NH4NO3,其工作原理如图所示,阴极反应式为NO+5e-+6H+=NH4++H2O;电解反应的总方程式为8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3;为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3.
分析 (1)铵根离子水解显酸性,碳酸根离子水解显碱性;
(2)先写出反应方程式,根据化合价的变化判断氧化产物和还原产物以及它们的物质的量之比;先求出1molNH4NO3爆炸放出的热量,再根据热化学方程式的书写要求写;
(3)由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答.
解答 解:(1)铵根离子水解显酸性,草木灰(K2CO3)中的碳酸根离子水解显碱性,碳酸根离子水解生成的氢氧根离子与铵根离子反应生成氨气,NH4++OH-═NH3+H2O,会降低铵态氮肥的肥效;
故答案为:不能;草木灰(K2CO3)水解显碱性,会产生大量氢氧根,NH4++OH-═NH3+H2O,把NH4NO3中的部分NH4+变成氨气,降低肥效;
(2)硝酸铵分解的方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O,该反应中氧化产物和还原产物都是N2O,一个铵根离子失去4个电子生成,一个参加氧化还原反应的硝酸根离子得到4个电子,所以铵根离子的个数与参加氧化还原反应的硝酸根离子的个数是1:1,所以氧化产物和还原产物的质量之比为1:1;
若32g 即0.4molNH4NO3爆炸放出12.3kJ的热量,则4molNH4NO3爆炸放出的热量为123kJ,则热化学方程式为:4NH4NO3(s)=3N2(g)+2NO2(g)+8H2O(g)△H=-123kJ/mol;
故答案为:1:1;4NH4NO3(s)=3N2(g)+2NO2(g)+8H2O(g)△H=-123kJ/mol;
(3)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,
故答案为:NO+5e-+6H+=NH4++H2O;8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3;NH3.
点评 本题考查盐的水解原理的应用、氧化还原反应、热化学方程式的书写、电解原理的应用等知识,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握.

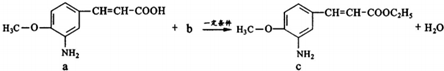
下列说法不正确的是( )
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
| A. | 密闭容器中CuO和C高温反应的气体产物: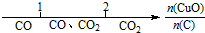 | |
| B. | Na2O2和等物质的量的CO2、H2O(g):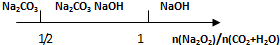 | |
| C. | NaOH溶液中通入一定量的CO2的产物: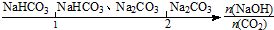 | |
| D. | AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: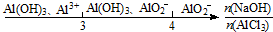 |
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |
| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
| A. | 按系统命名法,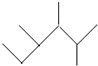 的名称为2,3-二甲基-4-乙基庚烷 的名称为2,3-二甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到乙烯,煤液化可得到煤焦油、粗氨水、粗苯等液体 | |
| D. | 1molHC≡CCHO最多能与3mol H2完全反应 |
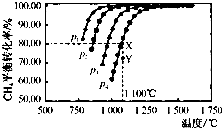
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1