题目内容
3.下列不能使溴水完全褪色的是( )| A. | 碳酸钠 | B. | 氢氧化钾溶液 | C. | 二氧化硫 | D. | KI溶液 |
分析 能使溴水褪色的物质应含有还原性离子、不饱和键、含有醛基等还原性基团的有机物、碱和碱性的无机物,反之不能使溴水褪色,以此解答该题.
解答 解:A.溴水中溴单质和水反应生成溴化氢和次溴酸,溴化氢和碳酸钠发生反应,促进平衡正向进行,溴水溶液颜色褪去,故A不符合;
B.溴单质和碱溶液发生反应,Br2+2KOH-KBr+KBrO+H2O,能使溴水完全褪色,故B不符合;
C.二氧化硫和溴单质在水溶液中发生反应生成硫酸和氢溴酸,溴水完全褪去,故C不符合;
D.碘化钾溶液中碘离子具有还原性,被溴单质氧化生成碘单质,溶液呈黄色,不能使溴水完全褪色,故D符合;
故选D.
点评 本题考查物质的性质,侧重于学生的分析能力的考查,题目难度不大,注意掌握溴水的组成、化学性质,明确能够使溴水褪色的物质一般具有的化学性质是解答本题关键.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
13.某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响.
(1)实验Ⅰ的作用是对照实验,证明实验Ⅱ和Ⅲ中的速率加快与溶液浓度无关.
(2)实验Ⅲ反应的化学方程式为2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑.
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率:
②不同催化剂的催化效率不同.
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准差状况)如下表所示:
0~6min,以H2O2的浓度变化表示的反应速率为v(H2O2)=0.033mol/(L•min).(计算结果精确到0.001)
| 序号 | 实验操作示意图 | 实验现象 |
| Ⅰ | 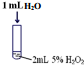 | 有极少量气泡产生 |
| Ⅱ | 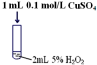 | 产生气泡速率略有加快 |
| Ⅲ | 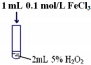 | 产生气泡速率明显加快 |
(2)实验Ⅲ反应的化学方程式为2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑.
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率:
②不同催化剂的催化效率不同.
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准差状况)如下表所示:
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| v(O2)mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
14.下列说法正确的是( )
| A. | L层上的电子数为奇数的原子一定是主族元素的原子 | |
| B. | 元素周期表中只有第IIA元素的原子最外层有两个电子 | |
| C. | 元素周期表中第Ⅷ族分占8、9、10三列,是元素种类最多的一族 | |
| D. | 元素周期表中位于金属和非金属交界线附近的元素属于过渡元素 |
11.N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A. | 上述反应中每生成1mol N2O,消耗67.2LCO | |
| B. | 等质量的N2O和CO2含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | 上述反应中若有3 mol的CO被还原,则转移6NA个电子 |
18.某可逆反应正向反应过程中能量变化如图所示,下列说法不正确的是( )
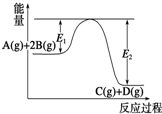

| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
8.常温时,下列说法正确的是( )
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |