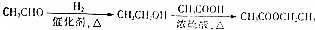题目内容
13.某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响.| 序号 | 实验操作示意图 | 实验现象 |
| Ⅰ | 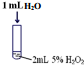 | 有极少量气泡产生 |
| Ⅱ | 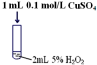 | 产生气泡速率略有加快 |
| Ⅲ | 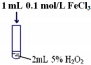 | 产生气泡速率明显加快 |
(2)实验Ⅲ反应的化学方程式为2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑.
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率:
②不同催化剂的催化效率不同.
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准差状况)如下表所示:
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| v(O2)mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
分析 (1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,作对照实验;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂;
(3)催化剂具有选择性;
(4)根据v=$\frac{△c}{△t}$计算得出.
解答 解:(1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,与Ⅱ、Ⅲ相同,作对照实验,证明实验Ⅱ和Ⅲ中的速率加快与溶液浓度无关,
故答案为:对照实验,证明实验Ⅱ和Ⅲ中的速率加快与溶液浓度无关;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂,反应方程式为:2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑;
(3)根据实验现象可知Ⅱ和Ⅲ在使用不同催化剂时化学反应速率不同,说明催化剂具有选择性,即不同催化剂的催化效率不同,
故答案为:不同催化剂的催化效率不同;
(4)0~6min中,收集到的氧气在标况下的体积为22.4mL,物质的量为0.001mol,根据关系式:2H2O2~O2可知双氧水分解的物的量为0.002mol,
所以双氧水浓度改变量△c=$\frac{0.002mol}{10×1{0}^{-3}L}$,v=$\frac{△c}{△t}$=$\frac{0.002mol}{10×1{0}^{-3}L×6min}$≈0.033mol/(L•min),
故答案为:0.033.
点评 本题通过对比实验考查催化剂对化学反应速率的影响,这是对教材实验的探究,化学反应速率的计算是高考常考点,注意计算的准确性,题目难度适中.

练习册系列答案
相关题目
3.在d轨道中电子排布成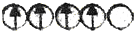 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )
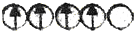 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )| A. | 能量最低原理 | B. | 洪特规则 | C. | 原子轨道能级图 | D. | 泡利不相容原理 |
4.下列说法不正确的是( )
| A. | 分馏石油气和裂解气可用溴水进行鉴别 | |
| B. | 异丁烷的二氯取代物有3种(不考虑立体异构) | |
| C. | 主链含四个碳的烷烃中,碳原子个数是最多的是2,3-四甲基丁烷 | |
| D. | 乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物 |
1.从海带中提取碘的涉及到下列操作步骤,其中不正确的是( )
| A. | 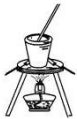 将海带灼烧成灰 将海带灼烧成灰 | B. | 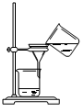 过滤得含I-的溶液 过滤得含I-的溶液 | ||
| C. |  向滤液中加稀H2SO4和H2O2溶液 向滤液中加稀H2SO4和H2O2溶液 | D. |  加入CCl4,萃取 加入CCl4,萃取 |
8.燃料电极是一种高效、环境友好的发电装置,某氢氧燃料电池的构造示意图如下,该电池工作时,下列说法正确的是( )

| A. | a电极是该电池的正极 | B. | O2在b电极上发生氧化反应 | ||
| C. | 电解质溶液中OH-向正极移动 | D. | 该装置实现了化学能到电能的转化 |
18.已知:Mg2Si+4HCl═SiH4↑+2MgCl2,下列说法正确的是( )
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
5.甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法正确的是( )
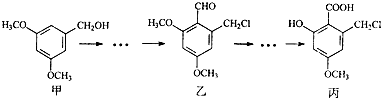

| A. | 甲、乙、丙三种有机化合物均可跟NaOH溶液反应 | |
| B. | 用FeCl3溶液区分甲、丙两种有机化合物 | |
| C. | 一定条件下丙可以与NaHCO3溶液、C2H5OH反应 | |
| D. | 乙、丙都能发生银镜反应 |
3.下列不能使溴水完全褪色的是( )
| A. | 碳酸钠 | B. | 氢氧化钾溶液 | C. | 二氧化硫 | D. | KI溶液 |
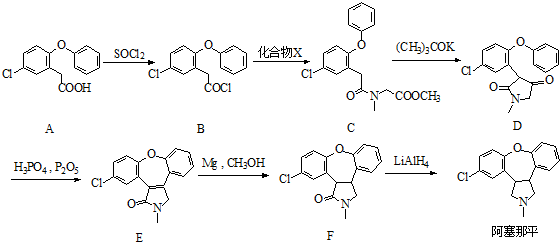
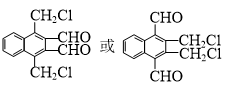 .
.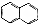 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;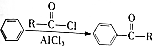 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和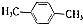 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: