题目内容
1.0.1mol•L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线所示,下列说法中正确的是( )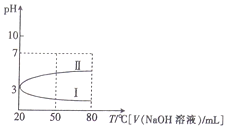
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
分析 A.铝离子水解显酸性抑制铵根离子水解,氢离子是酸抑制铵根离子水解;
B.向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,先生成氢氧化铝沉淀,再和铵根离子结合生成一水合氨,继续滴入生成的氢氧化铝沉淀溶解,据定量关系计算反应过程和溶液pH;
C.升高温度促进铝离子和铵根离子的水解;
D.溶液中存在电荷守恒分析,20°C溶液中离子积常数不知,不能计算氢氧根离子浓度.
解答 解:A.铝离子水解显酸性抑制铵根离子水解,氢离子是酸抑制铵根离子水解,氢离子抑制程度大,所以0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)小于等浓度的NH4HSO4溶液中c(NH4+),故A错误;
B.未加入氢氧化钠溶液,溶液PH=3,向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,物质的量之比为1:4,发生的反应是:Al3++3OH-=Al(OH)3↓,NH4++OH-=NH3•H2O,溶液pH增大,溶液pH的变化如曲线II,故B正确;
C.铝离子和铵根离子的水解过程为吸热反应,升温平衡正向进行,促进水解,故C错误;
D.20℃时,0.1mol•L-1NH4Al(SO4)2溶液中存在电荷守恒,2c(SO42-)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),c(H+)=10-3mol/L,2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol•L-1-c(OH-),故D错误;
故选B.
点评 本题考查了盐类水解、溶液酸碱性判断、影响水解平衡因素、电解质溶液中电荷守恒分析等,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案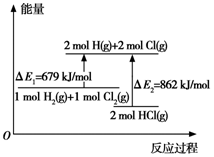
| A. | △E1是该反应的活化能 | B. | △E2是2 mol H-Cl键的总键能 | ||
| C. | 加入催化剂可以改变反应的焓变 | D. | 该反应是一个放热反应 |
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
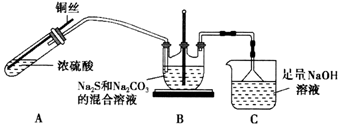
实验步骤如下:
①加热装置A,控制反应速率,使A中产生的气体均匀的通入B中,同时不断搅动,加热.
②当溶液的pH接近7时,停止通入SO2气体.
③将反应后的溶液转移至蒸发皿中,蒸发浓缩,到溶液表面出现晶膜时停止加热.再经冷却结晶、过滤、洗涤,将晶体放入烘箱中,在40℃左右干燥50~60min,得到产品.
回答下列问题:
(1)步骤①,在装置B中反应生成Na2S2O3,已知反应中只有一种变价元素,则B中反应的离子方程式为2S2-+CO32-+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3S2O32-+CO2.
(2)步骤②当溶液的pH接近7时,停止通入SO2气体的原因是Na2S2O3遇酸易分解,二氧化硫过量会使溶液的酸性增强,使产率降低.
(3)若要停止A中的化学反应,除熄灭酒精灯外,还可以采取的措施是将铜丝抽离液面.
(4)完成步骤③中的两处实验操作:蒸发浓缩、冷却结晶.
(5)为探究实验后装置C中溶液的溶质成分,该实验小组又进行了如下实验.
供选择的试剂为:Al(OH)3粉末、酚酞试液、稀硫酸、稀硝酸、Ba(NO3)2溶液
| 序号 | 操作及现象 | 结论 |
| ① | 取少量Al(OH)3粉末于试管中,滴加适量溶液,振荡,白色粉末溶解 | 溶质中一定含有NaOH |
| ② | 取2nL溶液于试管中,滴加足量氯水,氯水褪色丙有气泡产生,再滴加几滴Ba(NO3)2溶液,有白色沉淀产生 | 溶质为NaOH和 Na2CO3、Na2SO3 |
| 取2mL溶液于试管中,若 先加入足量稀硝酸,产生气泡,再滴入几滴Ba(NO3)2溶液,无沉淀产生 | 溶质为为NaOH和Na2CO3 |
| A. | 标准状况下,22.4L水中含有水分子数为NA | |
| B. | 1mol Na2CO3 固体中含有的钠离子数为NA | |
| C. | 16g O2中含有的氧原子数为NA | |
| D. | 0.1mol/L的NaOH溶液中含有OH-的数为NA |
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
| A. | 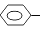 CH=CH2 CH=CH2 | B. | CH2=CH-CN | C. | CH2=CH-C(CH3)=CH2 | D. | CH2=CH-CH=CH2 |
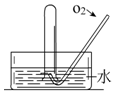 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.