题目内容
7.某同学根据课本第50页《科学探究》实验,设计了如下实验装置,完成高温下“Fe与水蒸气的反应实验”.(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).请回答该实验中的问题.
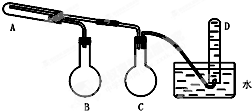
(1)写出该反应的反应方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4.
(2)烧瓶B的作用是产生H2O(g);烧瓶C的作用是防止倒吸(或用作安全瓶).
(3)如果要在气体导出管口点燃该气体,则必须对该气体进行验纯.
(4)装置中,试管A和烧瓶B均需加热,则加热的先后顺序是先B后A(填“先A后B”或“先B后A”).
(5)实验完毕后,取出A试管中的少量固体,溶于足量稀盐酸,再滴加KSCN溶液,溶液颜色无明显变化,试解释其原因:在溶液中Fe3+被未反应的铁粉完全还原为Fe2+.
分析 由实验装置可知,试管A是铁与水蒸气反应的装置,故在A中装的应该是普通铁粉,在反应过程中 要生成氢气,所以D是用来收集氢气的,烧瓶的作用就是加热液体或者对液体进行蒸馏,所以这里蒸馏瓶所起的作用就是产生水蒸气,为了防止向试管中通入水蒸气使试管骤冷,引起水的倒流从而在试管和收集气体的试管中间加上了广口瓶,保证实验安全,则A中是铁和水蒸气的反应,B中为产生水蒸气的装置,C为安全瓶防止倒吸的作用,D中收集的是氢气,以此来解答.
解答 解:(1)发生的反应为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$4H2+Fe3O4;
(2)B的作用为产生H2O(g);烧瓶C的作用为防止倒吸(或用作安全瓶),故答案为:产生H2O(g);防止倒吸(或用作安全瓶);
(3)因氢气不纯点燃发生爆炸,则要在气体导出管口点燃该气体,则必须对该气体进行验纯,故答案为:验纯;
(4)先加热A时Fe与氧气反应,为发生Fe与水蒸气的反应,则先提供水蒸气,即加热顺序为先B后A,故答案为:先B后A;
(5)滴加KSCN溶液,溶液颜色无明显变化,则不含铁离子,A试管中Fe剩余,即在溶液中Fe3+被未反应的铁粉完全还原为Fe2+,
故答案为:在溶液中Fe3+被未反应的铁粉完全还原为Fe2+.
点评 本题考查性质实验方案的设计,为高频考点,把握发生的反应、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
14.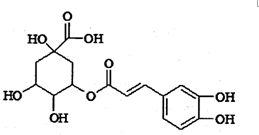 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同 |
15.水溶液中的行为是中学化学的重要内容.
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
25℃时,将浓度相同的四种盐溶液:①NaCN ②NaClO ③Na2CO3 ④NaHCO3,按pH由大到小的顺序排列③>①>②>④(填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为NaClO+CO2+H2O=NaHCO3+HClO.
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
12.在学习了溶液中的离子反应之后,小明同学认为反应中的先后顺序很重要,他们归纳了下面一些情况,在他所作的整理中,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向浓度均为0.1 mol/L的FeBr2通入少量氯气,Br-首先反应 |
2.下列说法中错误的是( )
| A. | 在豆浆里加入盐卤做豆腐,在河流入海处易形成沙洲都与胶体性质有关 | |
| B. | 淀粉胶体中混有的氯化钠可以通过渗析的方法除去 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 | |
| D. | Fe(OH)3悬浊液和Fe(OH)3胶体都不稳定,都不能透过滤纸 |
12. 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 醋酸中逐滴加入氢氧化钠溶液 | ||
| C. | 氢氧化钡溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
19.下列说法正确的是( )
| A. | 金刚石和石墨互为同位素 | |
| B. | C2H6和C5H12互为同系物 | |
| C. | C2H4和C2H6互为同系物 | |
| D. | CH3CH2CH2CH3和CH3CH(CH3)2互为同系物 |
16.下列说法不正确的是( )
| A. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| B. | 干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| C. | 用Al(OH)3治疗胃酸过多 | |
| D. | 光导纤维的主要成分是SiO2 |
17.下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+ MnO4- Cl- SO42- | B. | Na+ Ba2+ NO3- Cl- | ||
| C. | Na+ SO42- Cu2+ Cl- | D. | Na+ H+ NO3- SO42- |