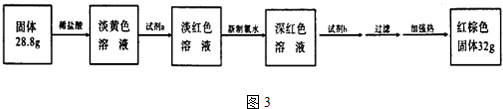
题目内容
3.下列叙述正确的是( )| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
分析 A.得电子的发生还原反应,失电子的发生氧化反应;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,根据转移电子数相等确定产物的物质的量之比;
C.根据氢氧化钠和转移电子之间的关系式计算;
D.作原电池负极的金属比作原电池正极的金属易腐蚀.
解答 解:A.电解池阴极上得电子发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,氢离子得2mol电子生成1mol氢气,4mol氢氧根离子失去4mol电子生成1mol氧气,所以阴阳两极产物的物质的量之比为2:1,故B错误;
C.设生成x氢氧化钠,
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ 转移电子
2mol 2mol
x 0.1mol
x=$\frac{2×0.1}{2}$mol=0.1mol,所以生成0.1mol氢氧化钠,故C正确;
D.镀层破损后,镀锡铁板中铁作负极,镀锌铁板中铁作正极,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,难度不大,注意选项B中生成1mol氧气需要转移4mol电子.

练习册系列答案
相关题目
14.某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
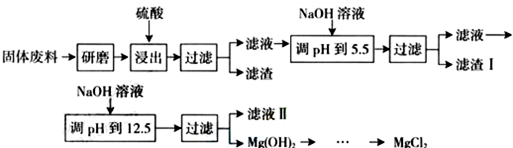
部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有升高温度、搅拌、多次浸取等(要求写出两条).
(2)滤渣I的主要成分有Fe(OH)3、Al(OH)3.
(3)从滤液Ⅱ中可回收利用的主要物质有Na2SO4.
(4)若将MgCl2溶液加热蒸干得到的固体是Mg(OH)2,若要得到MgCl2应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干.
(5)用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O.

部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
(2)滤渣I的主要成分有Fe(OH)3、Al(OH)3.
(3)从滤液Ⅱ中可回收利用的主要物质有Na2SO4.
(4)若将MgCl2溶液加热蒸干得到的固体是Mg(OH)2,若要得到MgCl2应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干.
(5)用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O.
11.生产中常要控制化学反应条件增大反应速率.下列措施中不能加快化学反应速率的是( )
| A. | 尽可能使用稀溶液 | B. | 选择合适的催化剂 | ||
| C. | 碾细固体反应物 | D. | 提高反应体系的温度 |
18.下列物质在一定条件下可以转化的是( )
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
8.(1)与标准状况下4.48L CO2中所含氧原子数目相同的水的质量是7.2g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
估算10片胃舒平和5片达喜,含铝的物质的量较多的是10片胃舒平.
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物(NOx)中含氮原子0.2mol,则x的数值为2;
(4)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为24.5L/mol,气体所处的条件不是(填“是”或“不是”)标准状况.
(5)下列是常用的中和胃酸的药物:
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |