题目内容
20.肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:负极的电极反应式:N2H4+4OH--4e-═4H2O+N2↑,正极的电极反应式:O2+4e-+2H2O═4OH-.分析 根据燃料电池的特点分析,产生环保,写出电池总反应,氧气在正极得电子发生还原反应,在酸性条件下生成水,在碱性条件下生成氢氧根,所以电极反应为:O2+4e-+2H2O═4OH-,总反应减正极得到负极反应式.
解答 解:根据燃料电池的特点分析,产生环保,电池总反应为N2H4+O2=N2↑+2H2O,燃料在负极失电子发性氧化反应,氧气在正极得电子发生还原反应,在酸性条件下生成水,在碱性条件下生成氢氧根,所以正极反应为:O2+4e-+2H2O═4OH-,总反应减正极得到负极反应式:N2H4+4OH--4e-=4H2O+N2↑,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;O2+4e-+2H2O═4OH-.
点评 本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,注意电解质溶液的酸碱性,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
11.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式  | |
| B. | S2-的结构示意图  | |
| C. | 乙烯的分子式 CH2=CH2 | |
| D. | 原子核内有l7个中子的氯原子${\;}_{17}^{35}$Cl |
8.硫原子与硫离子都属于硫元素的原因是( )
| A. | 具有相同的相对原子质量 | B. | 具有相同的中子数 | ||
| C. | 具有相同的核外电子数 | D. | 具有相同的质子数 |
5.在我国许多地区已发生过误食亚硝酸中毒事件.人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐则导致血红蛋白中Fe2+转化为高价铁血红蛋白而中毒.服用维生素C(Vc)可解除亚硝酸盐中毒.以下说法正确的是( )
| A. | Vc将Fe3+还原为Fe2+ | B. | Vc解毒未发生氧化还原反应 | ||
| C. | 亚硝酸盐是还原剂 | D. | Vc是氧化剂 |
12.下列实验方案,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl3晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 验证氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
9.(1)选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(2)等物质的量的甲烷、乙烯、乙炔、苯等四种有机物分别完全燃烧,需要O2最多的是苯;等质量的上述四种物质分别完全燃烧,需要O2最多的是甲烷.
(3)目前出现的“不粘锅”、不粘油的吸油烟机等等新型厨具,其秘密就是表面有一种叫做“特 富隆”的涂层,实际上就是号称“塑料王”的聚四氟乙烯.试写出用四氟乙烯合成“特富隆”的化学方程式及其反应类型.反应方程式:nCF2=CF2→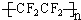 ,类型加聚反应.
,类型加聚反应.
| 除杂试剂 | 方法 | |
| C6H6 (C6H5OH) | ||
| C2H6 (C2H4) | ||
| C6H5Br (Br2) | . |
(3)目前出现的“不粘锅”、不粘油的吸油烟机等等新型厨具,其秘密就是表面有一种叫做“特 富隆”的涂层,实际上就是号称“塑料王”的聚四氟乙烯.试写出用四氟乙烯合成“特富隆”的化学方程式及其反应类型.反应方程式:nCF2=CF2→
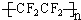 ,类型加聚反应.
,类型加聚反应.
10.下列有关化学反应速率与限度的说法,正确的是( )
| A. | 任何可逆反应都有一定的限度,且限度是可以改变的 | |
| B. | 对任何化学反应来说,反应速率越大,则现象越明显 | |
| C. | 决定化学反应速率的主要因素是温度、浓度、压强 | |
| D. | 铁与稀硫酸反应制氢气时,改用98.3%的浓硫酸,对增大化学反应速率明显有效 |


 .
.