题目内容
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
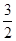 H2+
H2+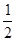 N2的平衡常数为( )
N2的平衡常数为( )
| A.a-1/2 | B.a1/2 | C.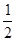 a a | D.a-2 |
A
解析试题分析:
NH3
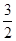 H2+
H2+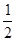 N2的平衡常数为:
N2的平衡常数为: ,因此,选A。
,因此,选A。
考点:考查化学平衡常数。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
| 反应放出或吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
一定条件下,在容积不变的密闭容器中加入P、Q进行反应P(g)+2Q(g)  3R(g)+S(l),说明该反应已达到平衡的是
3R(g)+S(l),说明该反应已达到平衡的是
| A.反应容器中气体的平均摩尔质量不再改变 |
| B.反应容器中P、Q、R、S四者共存 |
| C.2v正(Q)="3" v逆(R) |
| D.反应容器中压强不随时间变化而变化 |
下列说法中正确的是( )
| A.凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B.自发反应在恰当条件下才能实现 |
| C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
某温度下,密闭容器中发生反应aX(g)  bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g)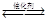 CO2(g) + H2(g) △H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g) + H2(g) △H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
现有可逆反应A(g)+2B(g) nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
| A.p1>p2,n>3 |
| B.p1<p2,n>3 |
| C.p1<p2,n<3 |
| D.p1>p2,n=3? |
 pC(g)+qD(g);△H<0.下列结论中不正确的是
pC(g)+qD(g);△H<0.下列结论中不正确的是