题目内容
一定条件下,在容积不变的密闭容器中加入P、Q进行反应P(g)+2Q(g)  3R(g)+S(l),说明该反应已达到平衡的是
3R(g)+S(l),说明该反应已达到平衡的是
| A.反应容器中气体的平均摩尔质量不再改变 |
| B.反应容器中P、Q、R、S四者共存 |
| C.2v正(Q)="3" v逆(R) |
| D.反应容器中压强不随时间变化而变化 |
A
解析试题分析:A、正确;B、即使未达到平衡,反应容器中P、Q、R、S四者也会共存,错误;C、2v正(Q)="3" v逆(R) 是个恒等式,不管是否达到平衡,错误;D 、因为反应物和生成物的体积一样,所以压强一直不变,错误。
考点:考查化学平衡。

练习册系列答案
相关题目
从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 4NO2(g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
决定化学反应速率快慢的根本因素是
| A.温度和压强 |
| B.反应物的浓度 |
| C.参加反应的各物质的性质 |
| D.催化剂的加入 |
已知反应4CO(g)+2NO2(g) N2(g)+4CO2(g)在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2(g)+4CO2(g)在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是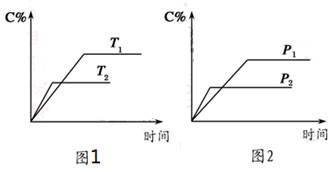
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,p2>p1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
反应2SO2(g)+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
| A.0.1s | B.2.5s | C.10s | D.5s |
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
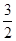 H2+
H2+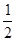 N2的平衡常数为( )
N2的平衡常数为( )
| A.a-1/2 | B.a1/2 | C.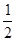 a a | D.a-2 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0
4NO2 (g)+ O2(g) ΔH > 0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是