题目内容
现有可逆反应A(g)+2B(g) nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是( )
| A.p1>p2,n>3 |
| B.p1<p2,n>3 |
| C.p1<p2,n<3 |
| D.p1>p2,n=3? |
B
解析试题分析:根据平衡图像题的解题方法:①先拐先平,速率快②定一议二原则知,压强p2到达平衡时间短,反应速率快,故图象中p1<p2;由图像知压强为p2时达平衡后A的转化率降低,说明平衡逆向移动,增大压强平衡向气体体积减小的方向移动,故n>3,选B.
考点:考查化学平衡图像。

练习册系列答案
相关题目
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
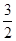 H2+
H2+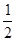 N2的平衡常数为( )
N2的平衡常数为( )
| A.a-1/2 | B.a1/2 | C.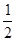 a a | D.a-2 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0
4NO2 (g)+ O2(g) ΔH > 0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
某可逆反应aA+bB cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
A.写成2aA+2bB 2cC,Q值、K值均扩大了一倍 2cC,Q值、K值均扩大了一倍 |
B.写成2aA+2bB 2cC,Q值扩大了一倍,K值保持不变 2cC,Q值扩大了一倍,K值保持不变 |
C.写成cC aA+bB,Q值、K值变为原来的相反数 aA+bB,Q值、K值变为原来的相反数 |
D.写成cC aA+bB,Q值变为原来的相反数,K值变为倒数 aA+bB,Q值变为原来的相反数,K值变为倒数 |
将X和Y以1:2的体积比混合后置于密闭容器中,加压到3×107Pa,发生如下反应:X(g)+2Y(g)?2Z(g),达到平衡状态时,测得反应物的总物质的量和生成物的总物质的量相等,有关数据如图,则反应对应的温度是( )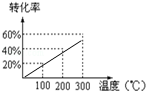
| A.100℃ | B.200℃ | C.300℃ | D.不能确定 |
对于一可逆反应,当确知平衡向正反应方向移动,下列说法肯定正确的是
| A.反应物的转化率将提高 | B.生成物的产量将增加 |
| C.生成物的浓度将增大 | D.生成物的百分含量将增大 |
图为某化学反应速率一时间图。在 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
C.H2(g)+I2(g) 2HI(g); ΔH>0 2HI(g); ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g) ;ΔH>0 CO(g)+H2(g) ;ΔH>0 |
在密闭容器中进行下列反应M(g)+N(g) R(g)+2L:反应符合如图所示的图象.下列叙述正确的是
R(g)+2L:反应符合如图所示的图象.下列叙述正确的是
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
下列事实不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率 |