题目内容
将气体A、B置于容积为2L的密闭容器中,发生如下反应:
4A(g)+B(g)=2C(g)
反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则:
用反应物A浓度的减少来表示该反应的速率应为
用反应物B浓度的减少来表示该反应的速率应为
用生成物C浓度的增加来表示该反应的速率应为
(1)0.05mol/(L·s)(2)0.0125mol/(L·s)(3)0.025mol/(L·s)
解析试题分析:4A(g)+B(g)=2C(g)
起始:(4x+0.5)(x+0.4)0
转化:4xmolxmol2xmol
4s末:0.5mol0.4mol0.2mol
2x=0.2molx=0.1mol
⑴用反应物A浓度的减少来表示该反应的速率应为: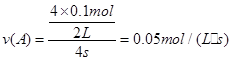
⑵依据化学反应速率之比等于化学计量数之比可知,用反应物B浓度的减少来表示该反应的速率应为: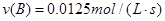
⑶依据化学反应速率之比等于化学计量数之比可知,用反应物C浓度的增加来表示该反应的速率应为: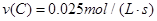
考点:考查化学反应速率。

下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法。 |
可逆反应A(?)+aB(g)  C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是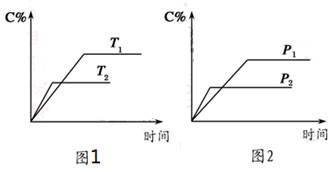
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,p2>p1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
反应2SO2(g)+O2 2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
2SO3(g)经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s),则这段时间为( )
| A.0.1s | B.2.5s | C.10s | D.5s |
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是( )
2C(g),下列说法中正确的是( )
| A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K= |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
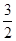 H2+
H2+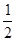 N2的平衡常数为( )
N2的平衡常数为( )
| A.a-1/2 | B.a1/2 | C.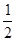 a a | D.a-2 |
可逆反应aA(g)+bB(g) cC(g)+dD(g)符合下图。则下列叙述正确的是
cC(g)+dD(g)符合下图。则下列叙述正确的是

| A.a+b>c+d;正反应放热 |
| B.a+b<c+d;正反应吸热 |
| C.a+b<c+d;正反应放热 |
| D.a+b>c+d;正反应吸热 |
某可逆反应aA+bB cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
cC+Q在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
A.写成2aA+2bB 2cC,Q值、K值均扩大了一倍 2cC,Q值、K值均扩大了一倍 |
B.写成2aA+2bB 2cC,Q值扩大了一倍,K值保持不变 2cC,Q值扩大了一倍,K值保持不变 |
C.写成cC aA+bB,Q值、K值变为原来的相反数 aA+bB,Q值、K值变为原来的相反数 |
D.写成cC aA+bB,Q值变为原来的相反数,K值变为倒数 aA+bB,Q值变为原来的相反数,K值变为倒数 |
 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是