题目内容
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
| 反应放出或吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
B
解析试题分析:A、甲与丙的初始用量相当,会建立相同(等效)平衡,只不过建立平衡时反应的方向不同,所以e=g 而且a≠c,错误;B、甲与乙相比较,甲的用量比乙多一倍,在温度和体积相同的条件下,甲中平衡的建立可以在两个乙的基础上,再压缩为1L,但压缩时平衡会右移,所以a>2b,e>2f ,正确;C、甲与丁相比较,丁的平衡可以在甲平衡的基础上再增加1mol氧气,但平衡会向右移动,错误;D、设反应 2SO2 + O2 =" 2SO3" 的转化率为m,则有:e=m所以,反应 2SO3 =" 2SO2" + O2 的转化率为1-m,则:c=+196.6(1-m)所以,c+98.3e=196.6,错误。
考点:化学平衡。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
从下列事实所得出的解释或结论正确的是
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 4NO2(g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法。 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)  ?nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
?nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 容器体积/L 温度/℃ c(Y)/mol·L-1 | 1 L | 2 L | 4 L |
| 100℃ | 1.00 | 0.75 | 0.53 |
| 200℃ | 1.20 | 0.90 | 0.63 |
| 300℃ | 1.30 | 1.00 | 0.70 |
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
决定化学反应速率快慢的根本因素是
| A.温度和压强 |
| B.反应物的浓度 |
| C.参加反应的各物质的性质 |
| D.催化剂的加入 |
某温度时,反应N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
2NH3的平衡常数K=a,则此温度下,NH3
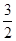 H2+
H2+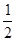 N2的平衡常数为( )
N2的平衡常数为( )
| A.a-1/2 | B.a1/2 | C.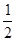 a a | D.a-2 |
 zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白: 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是