题目内容
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是

A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在蒸发皿中加热制无水MgCl2
C.在第④步中的反应离子方程式为Br2+SO2+2H2O=2H+ +SO42-+2HBr
D.第⑤步涉及的分离操作有过滤、萃取、蒸馏
A
【解析】
试题分析:A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液可以除去Mg2+、Fe3+可以形成Fe(OH)3、Mg(OH)2;再加入BaCl2溶液,可以形成BaSO4沉淀,除去SO42-;加入碳酸钠溶液,可以形成CaCO3、BaCO3沉淀,除去Ca2+及引入的Ba2+。将沉淀过滤除去,后加盐酸调节溶液的酸碱性,就得到NaCl溶液,正确;B.MgCl2是强酸弱碱盐,在溶液中发生水反应产生Mg(OH)2、HCl,HCl蒸发,所以第②步中结晶出的MgCl2·6H2O若在蒸发皿中加热得到的是Mg(OH)2,错误;C.HBr是强酸,完全电离,在第④步中的反应离子方程式为Br2+SO2+2H2O=4H+ +SO42-+2Br-,错误;D.第⑤步涉及的分离操作是蒸发浓缩、蒸馏,错误。
考点:考查以海水为原料除去杂质的方法、混合物的分离方法、盐的水解、离子方程式的书写的知识。

(16分)下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)⑤、⑥、⑦的离子半径由大到小的顺序为 。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为 。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式: 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式: 。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为 。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为 。
 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。

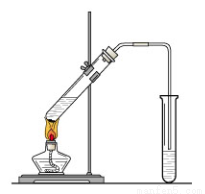
 Na2S2O3(aq)
Na2S2O3(aq)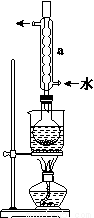
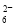 +2I-
+2I-