题目内容
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
(1)钛有
Ti和
Ti两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如图1所示,它的化学式是 ;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2:
化合物甲的分子中采取sp2杂化的碳原子个数为 ,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 .
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2?H2O.配离子[TiCl(H2O)5]2+ 中含有的化学键
类型是 ,该配合物的配体是 .
(5)分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图3示,下列说法不正确的是
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价.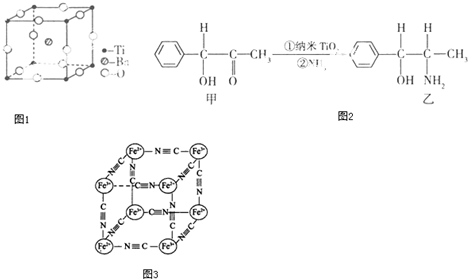
(1)钛有
48 22 |
50 22 |
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如图1所示,它的化学式是
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2:
化合物甲的分子中采取sp2杂化的碳原子个数为
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2?H2O.配离子[TiCl(H2O)5]2+ 中含有的化学键
类型是
(5)分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图3示,下列说法不正确的是
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价.

考点:原子核外电子排布,配合物的成键情况,晶胞的计算
专题:化学键与晶体结构
分析:(1)根据同位素的概念判断,根据核外电子排布规律写电子排布式;
(2)利用均摊法计算晶胞中各种原子的个数,进而确定化学式;
(3)根据有机物中碳原子的成键情况确定sp2杂化的原子个数,根据价层电子对数判断sp3杂化的原子种类,再根据元素周期律判断第一电离能的大小;
(4)根据配合物结构中配体与中心离子之间是配位键、配体内部是共价键,据此答题;根据配体提供孤电子对,中心离子提供空轨道,据此判断配体;
(5)A、该晶体中含有Fe2+、Fe3+、CN-等阴阳离子,据此判断晶体类型;
B、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断;
C、根据晶胞结构,利用均摊法确定晶胞中各离子个数比可判断;
D、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断.
(2)利用均摊法计算晶胞中各种原子的个数,进而确定化学式;
(3)根据有机物中碳原子的成键情况确定sp2杂化的原子个数,根据价层电子对数判断sp3杂化的原子种类,再根据元素周期律判断第一电离能的大小;
(4)根据配合物结构中配体与中心离子之间是配位键、配体内部是共价键,据此答题;根据配体提供孤电子对,中心离子提供空轨道,据此判断配体;
(5)A、该晶体中含有Fe2+、Fe3+、CN-等阴阳离子,据此判断晶体类型;
B、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断;
C、根据晶胞结构,利用均摊法确定晶胞中各离子个数比可判断;
D、根据晶胞结构,利用均摊法确定晶胞中各离子个数,再根据化合价代数各为零可判断.
解答:
解:(1)因为
Ti和
Ti的质子数相同而中子数不同,所以它们互为同位素,Ti是22号元素,根据核外电子排布规律可知钛基态原子的电子排布式为1s22s22p63s23p63d24s2,故答案为:同位素;1s22s22p63s23p63d24s2;
(2)根据均摊法可知晶胞中O原子的个数为12×
=3,Ti原子的个数为8×
=1,Ba原子的个数为1,所以化学式为TiBaO3,故答案为:TiBaO3;
(3)在有机物甲中苯环上的碳原子和碳氧双键中的碳原子都是按sp2杂化,所以sp2杂化的碳原子个数是7个,在有机物乙中,支链中的碳、氨基中氮、羟基中的氧的价层电子对数都是4,都是按sp3杂化的,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:7;N>O>C;
(4)根据配合物结构中配体与中心离子之间是配位键、配体内部是共价键,在[TiCl(H2O)5]2+中H2O和Cl-提供孤电子对,做配体,故答案为:共价键、配位键;H2O、Cl-;
(5)A、该晶体中含有Fe2+、Fe3+、CN-等阴阳离子,所以该晶体为离子晶体,故A正确;
B、根据图3晶胞结构可知,晶胞中含有Fe2+的个数为4×
=
,Fe3+的个数为4×
=
、CN-的个数为12×
=3,所以Fe2+、Fe3+、CN-的个数比为1:1:6,根据化合价代数和为零可知,M的化合价为+1价,故B错误;
C、根据晶胞结构,每个晶胞中含有Fe2+0.5个,Fe3+0.5个,CN-3个,因为由B可知M的化合价为+1价,根据化合价代数为零,可知含有M也是0.5个,所以且M+空缺率为50%,故C正确;
D、由B的分析可知,晶体的化学式可表示为MFe2(CN)6,且M为+1价,故D正确;
故选B.
48 22 |
50 22 |
(2)根据均摊法可知晶胞中O原子的个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
(3)在有机物甲中苯环上的碳原子和碳氧双键中的碳原子都是按sp2杂化,所以sp2杂化的碳原子个数是7个,在有机物乙中,支链中的碳、氨基中氮、羟基中的氧的价层电子对数都是4,都是按sp3杂化的,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:7;N>O>C;
(4)根据配合物结构中配体与中心离子之间是配位键、配体内部是共价键,在[TiCl(H2O)5]2+中H2O和Cl-提供孤电子对,做配体,故答案为:共价键、配位键;H2O、Cl-;
(5)A、该晶体中含有Fe2+、Fe3+、CN-等阴阳离子,所以该晶体为离子晶体,故A正确;
B、根据图3晶胞结构可知,晶胞中含有Fe2+的个数为4×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
C、根据晶胞结构,每个晶胞中含有Fe2+0.5个,Fe3+0.5个,CN-3个,因为由B可知M的化合价为+1价,根据化合价代数为零,可知含有M也是0.5个,所以且M+空缺率为50%,故C正确;
D、由B的分析可知,晶体的化学式可表示为MFe2(CN)6,且M为+1价,故D正确;
故选B.
点评:本题主要考查原子核外电子排布、均摊法计算化学式、化学键的判断、晶体结构的确定等知识点,中等难度,有一定的综合性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、铁管道与直流电源负极相连,防止铁管道腐蚀 |
| B、小苏打、氢氧化铝可用于治疗胃酸过多 |
| C、工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 |
| D、除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤 |
将a mol Na和amol Al一同投入mg足量水中,所得溶液密度为dg?cm-3,该溶液的质量分数为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
由K2SO4、Al2(SO4)?3、H2SO4及KAl(SO4)?2?12H2O组成的混合溶液,测得c(H+)?=0.1mol?L-1,c(Al3+)=0.4mol?L-1,c(SO42-)?=0.8mol?L-1,则c(K+)为( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,48gO3含有的氧原子数约为3NA个 |
| B、常温常压下,11.2L乙烯(C2H4)含有2NA个碳原子 |
| C、1.7g氨气所含有的电子数目为10NA |
| D、71gCl2中共有17NA个质子 |
 结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有
结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有