题目内容
(1)如图1,在干冰晶体中每个CO2分子周围紧邻的 CO2分子有 个 在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形的平面上有 个C02分子.
(2)已知白磷是由P4分子形成的分子晶体,每个P4分子是正四面体 结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有 个P-P键.
结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有 个P-P键.
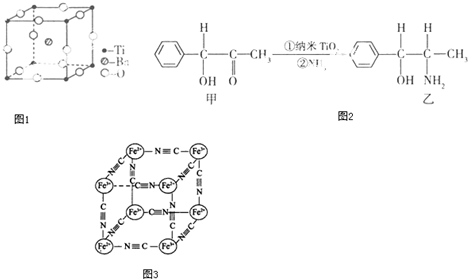
(3)现有甲、乙、丙、丁四种晶胞(如图2所示),可推知:甲晶体中A与B的离子个数比为 ; 乙晶体的化学式为 ;丙晶体的化学式为 ; 丁晶体的化学式为 .

(2)已知白磷是由P4分子形成的分子晶体,每个P4分子是正四面体
 结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有
结构.分子中的四个磷原子位于正四面体的四个顶点.则P4分子中共有(3)现有甲、乙、丙、丁四种晶胞(如图2所示),可推知:甲晶体中A与B的离子个数比为

考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,据此答题;由CO2晶体模型分析得出,符合题意的最小正方形即模型的对角面的一半;
(2)根据白磷的结构图 分析;
分析;
(3)采用均摊法,结合图象分析.
(2)根据白磷的结构图
 分析;
分析;(3)采用均摊法,结合图象分析.
解答:
解:(1)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;由CO2晶体模型分析得出,符合题意的最小正方形即模型的对角面的一半 ,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分
,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分
故答案为:12;4;
(2)由白磷的结构图 可知,P4分子中共有6个P-P键;
可知,P4分子中共有6个P-P键;
故答案为:6;
(3)根据均摊法,在甲图中,A离子位于晶胞立方体的体心,数目为1,B离子位于立方体的顶点,数目为
×8=1,所以A与B的离子个数比为1:1,在乙图中,C原子位于体心,数目为1,D原子位于顶点,数目为4×
=
,所以C和D的原子个数之比为2:1,乙晶体的化学式为C2D,在丙图中,E原子位于立方体不相邻的四个顶点,数目为4×
=
,F原子位于立方体不相邻的四个顶点,数目为4×
=
,所以E和F的原子个数之比为1:1,丙晶体的化学式为EF,在丁图中X原子位于体心,数目为1,Y原子位于立方体的四个面心,数目为4×
=2,Z原子位于立方体的八个顶点,数目为8×
=1,所以在丁晶体中XYZ三种原子的个数比为1:2:1,所以丁晶体的化学式为 XY2Z;
故答案为:1:1;C2D;EF;XY2Z.
 ,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分
,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分故答案为:12;4;
(2)由白磷的结构图
 可知,P4分子中共有6个P-P键;
可知,P4分子中共有6个P-P键;故答案为:6;
(3)根据均摊法,在甲图中,A离子位于晶胞立方体的体心,数目为1,B离子位于立方体的顶点,数目为
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:1:1;C2D;EF;XY2Z.
点评:本题考查了晶胞的结构,侧重于考查晶胞结构的分析和计算,注意利用均摊法计算晶胞中各种原子个数,题目难度中等,解题关键是仔细观察晶胞结构图.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列物质中属于电解质的是( )
| A、铁 | B、酒精 |
| C、五氧化二氮 | D、氯化氢 |
下列反应中,有电子转移,但不属于置换反应的是( )
| A、铝粉与硫酸铜溶液的反应 |
| B、氧气与一氧化碳的反应 |
| C、氢气还原氧化铜的反应 |
| D、氢氧化铁与稀硫酸的反应 |
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为( )
| A、直线形 sp杂化 |
| B、三角形 sp2杂化 |
| C、三角锥形 sp2杂化 |
| D、三角锥形 sp3杂化 |
将40%(密度为1.43g/mL)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数将( )
| A、等于20% | B、小于20% |
| C、大于20% | D、无法确定 |
2molCl2和2molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、质子数相等 | D、质量相等 |