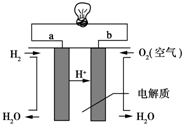
��Ŀ����
12��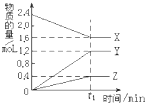 I��ij�¶��£���2L������3�����ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1minʱ����ƽ�⣬��ͼ��ʾ��
I��ij�¶��£���2L������3�����ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1minʱ����ƽ�⣬��ͼ��ʾ����1���÷�Ӧ�Ļ�ѧ����ʽ��2X
 3Y+Z��
3Y+Z����2����������Ӧ��X��Y��Z�ֱ�ΪNH3��H2��N2������֪1mol�����ֽ�ɵ���������Ҫ����46kJ������������t1minʱ���÷�Ӧ���յ�����Ϊ��36.8kJ���ڴ�t1minʱ���ڣ���H2��ʾ��Ӧ��ƽ������v��H2��=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1��
II���������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ�ǣ�Na2SO3+KIO3+H2SO4�TNa2SO4+K2SO4+I2+H2O���÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���¼�����
��IO3-+SO32-��IO2-+SO42-������ ��IO2-+SO32-��IO-+SO42-���죩
��5I-+6H++IO3-��3I2+3H2O���죩 ��I2+SO32-+H2O��2I-+SO42-+2H2���죩
��1���������������Ʋ⣬�˷�Ӧ���ܵķ�Ӧ�����ɵڢٲ���Ӧ������
��2����Ԥ�ȼ��������Һ��������������SO32-����������ʱ���Ż���ʹ���۱��������������
���� I����1����ͼ����Կ�������Ӧ��X�����ʵ�����С��Y��Z�����ʵ������࣬��XΪ��Ӧ�Y��ZΪ������ҡ�n��X������n��Y������n��Z��=0.8mol��1.2mol��0.4mol=2��3��1���ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮��ȷ������ʽ��
��2����֪1mol�����ֽ�ɵ���������Ҫ����46kJ��������t1minʱ������NH3�����ʵ���Ϊ0.8mol����Ӧ�������仯�����ʵ��������ȣ�
���v=$\frac{��c}{��t}$���������ķ�Ӧ���ʣ�
II����1��������Ӧ����������Ӧ������
��2��SO32-�Ļ�ԭ�Դ���I-���ɱ�I2����������������SO32-���Ż�����I2��
��� �⣺I����1����ͼ����Կ�������Ӧ��X�����ʵ�����С��Y��Z�����ʵ������࣬��XΪ��Ӧ�Y��ZΪ������ҡ�n��X������n��Y������n��Z��=0.8mol��1.2mol��0.4mol=2��3��1��t1minʱ��Ӧ�ﵽƽ�⣬�ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ�Ļ�ѧ����ʽΪ2X 3Y+Z��
3Y+Z��
�ʴ�Ϊ��2X 3Y+Z��
3Y+Z��
��2��t1minʱ������NH3�����ʵ���Ϊ0.8mol�������յ�����Ϊ0.8mol��46kJ/mol=36.8kJ��
H2�ķ�Ӧ����ΪY�����ڴ�t1minʱ���ڣ���H2��ʾ��Ӧ��ƽ������v��H2��=$\frac{\frac{1.2mol}{2L}}{{t}_{1}min}$=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1��
�ʴ�Ϊ��36.8kJ��$\frac{0.6}{{t}_{1}}$mol•L-1•min-1��
II����1��������Ӧ����������Ӧ���̵����ʣ��ʷ�Ӧ�����ɢٲ���Ӧ�������ʴ�Ϊ���٣�
��2���ɷ�Ӧ�ܿ�֪��SO32-�Ļ�ԭ�Դ���I-���ɱ�I2����������������SO32-���Ż�����I2���Ż�����Һ����������������ʴ�Ϊ��SO32-��
���� ���⿼�����ʵ�����ʱ��ı仯���ߣ�Ϊ��Ƶ���㣬����ͼ�����ʵ����ı仯����Ӧ�����뻯ѧ�������Ĺ�ϵ����Ӧ����Ӱ�����ص�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע������Ӧ����������Ӧ�ķ�Ӧ���ʣ���Ŀ�ѶȲ���

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д�| A�� | 16g O2��O3�Ļ�������к��е�ԭ����ΪNA | |
| B�� | ��1L0.1 mol/L̼������Һ�У�CO32-����Ϊ0.1 NA | |
| C�� | ��״���£�22.4 LSO3��ˮ��Ӧ����1mol���� | |
| D�� | ��״���£�22.4L Cl2��ȫ����������ԭ��Ӧһ��ת��2NA������ |
| A�� | CH2Br-CH2Br �������� | B�� | CH3CH��NH2��CH2COOH 3-�������� | ||
| C�� | 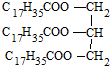 Ӳ֬�����֬ Ӳ֬�����֬ | D�� | 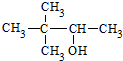 2��2-����-3-���� 2��2-����-3-���� |
 ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣���1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C��s��+H2O��g��?CO��g��+H2��g��
һ���¶��£���һ���ݻ��̶����ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����bc��������ĸ��
a�������е�ѹǿ���ٸı�
b.1mol H-H�����ѵ�ͬʱ����2mol H-O��
c��v����CO��=v����H2O��
d��c��CO��=c��H2��
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
��3��Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��
CO2��g��+3H2��g��?CH3OH��g��+H2O��g������ͼ��ʾ�÷�Ӧ���й����������ı仯�������Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��Ӧ�ﵽƽ������¶���ʹc��CH3OH�������������С�����䡱����
| A�� | NaCl��Һ | B�� | NaOH��Һ | C�� | H2SO4��Һ | D�� | CuSO4��Һ |
| ѡ�� | ʵ������ | ԭ����� |
| A | Ũ������Һ�г�ζ | ������ˮ���������⣬������г�ζ |
| B | ������ˮ�еμ�ʯ����Һ����Һ�ȱ�죬����ɫ | ������ˮ��Ӧ����HCl��HClO��HCl��ǿ���ԣ�ʹʯ���죬HClO����ǿ�����ԣ�ʹ����ɫ |
| C | SO 2ͨ����ˮ�У���ˮ��ɫ | SO 2����Ư���ԣ�ʹ����ɫ |
| D | ��Na2CO3��Һ��ͨ������CO2���壬��Һ����� | ������NaHCO3���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
 ���û������л�ѧ�����������Ӽ������ۼ���
���û������л�ѧ�����������Ӽ������ۼ��� ��
��