题目内容
17. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2(g)
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc.(填字母)
a.容器中的压强不再改变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2反应达到平衡后,降低温度能使c(CH3OH)增大(填“增大”“减小”或“不变”).
分析 (1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断;
(2)由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO);
(3)第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应,降温平衡正向进行.
解答 解:(1)a.反应前后气体的物质的量不发生变化,容器中始终压强不变,不能说明反应到达平衡,故a错误;
b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确;
c.根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选:bc;
(2)由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/L•min,故答案为:0.16mol/(L•min);
(3)实验1中CO的转化率为$\frac{4mol-2.4mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{2mol-1.6mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,逆反应是吸热反应,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2反应达到平衡后,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),降低温度平衡正向进行,能使c(CH3OH)增大,
故答案为:增大.
点评 本题考查反应速率、化学平衡状态判断、化学平衡有关计算、图象和数据的分析应用,题目难度中等,注意对知识的理解与掌握,是对学生能力的考查.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=40 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
| A. | Li、Na、K、Rb的沸点逐渐降低 | |
| B. | 与硅相比,金刚石的硬度大、熔点高 | |
| C. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| D. | H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶 |
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |

 表中所示物质或概念间的从属关系符合右图的是( )
表中所示物质或概念间的从属关系符合右图的是( )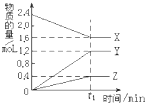 I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z.
3Y+Z. 石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.
石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.