题目内容
1.用石墨做电极电解下列溶液,通电一段时间后溶液的pH变大的是( )| A. | NaCl溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | CuSO4溶液 |
分析 用石墨作电极,电解下列物质的溶液,通电一段时间后溶液的pH变大,说明该电解质溶液中氢离子浓度减小,则溶液中的电解质不能是含氧酸、含氧酸盐等,结合电解原理来回答.
解答 解:A、电解氯化钠得到的是氢氧化钠溶液,所以碱性增强,pH变大,故A正确;
B、电解氢氧化钠相当于电解水,所以溶液的碱性增加,pH变大,故B正确;
C、电解硫酸相当于电解水,所以溶液的碱性减弱,酸性增加,pH变小,故C错误;
D、电解硫酸铜,得到的是硫酸溶液,所以pH降低,故D错误.
故选AB.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,根据各个电极上放电的离子结合溶液中氢离子或氢氧根离子浓度变化来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.已知维生素A的结构简式为:

关于它的叙述正确的是( )

关于它的叙述正确的是( )
| A. | 维生素A的分子式为C20H32O | |
| B. | 维生素A可被催化氧化为醛 | |
| C. | 维生素A是一种易溶于水的醇 | |
| D. | 1mol维生素A在催化剂作用下最多可与7mol H2发生加成反应 |
13.如表是部分短周期元素的原子半径及主要化合价
①L元素的名称是镁,R元素的名称是硫.
②能与T元素组成的化合物具有两性的是BeO、Al2O3(写化学式).
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
②能与T元素组成的化合物具有两性的是BeO、Al2O3(写化学式).
10.我国钨资源矿产丰富.由黑钨矿提取钨发生的反应之一为:3H2+WO3$\frac{\underline{\;高温\;}}{\;}$W+3H2O.其基本反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
11.下列气体中,既能用碱石灰干燥,又能用排水法收集的是( )
| A. | CO | B. | NO2 | C. | SO2 | D. | NH3 |

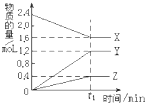 I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示: 3Y+Z.
3Y+Z. 石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.
石油中溶有一种碳氢化合物-金刚烷.金刚烷 是一种环状烃,它的结构高度对称.下图表示金刚烷,图中数字是碳原子编号.碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子.