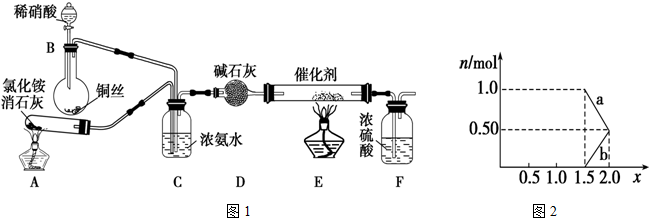
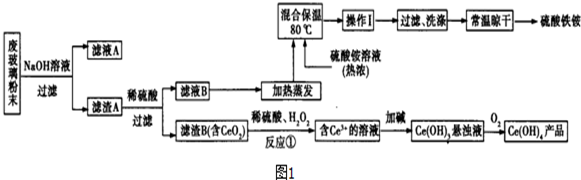
题目内容
6.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑.有关该反应的说法不正确的是( )| A. | 该反应中的还原剂是C、氧化剂是S和KNO3 | |
| B. | 能做炸药的原因之一是固体物质反应生成了大量的气体 | |
| C. | 由此反应可推出S的氧化性强于N2 | |
| D. | 当生成标准状况下4.48L气体时,共转移电子0.6 mol |
分析 反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,N和S元素化合价降低,被还原,C元素化合价升高,被氧化,据此分析.
解答 解:A.反应中N和S元素化合价降低,被还原,C元素化合价升高,所以还原剂是C、氧化剂是S和KNO3,故A正确;
B.固体物质反应生成了大量的气体,压强增大,发生爆炸,故B正确;
C.该反应不能比较S和氮气的氧化性强弱,故C错误;
D.生成标准状况下4.48L气体时,即0.2mol气体,则生成0.05mol氮气,有0.15molC参加反应,共转移电子0.6 mol,故D正确.
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意把握元素化合价的变化,从化合价的角度理解氧化还原反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列四位同学在讨论分子式CH4的意义,其中错误的是( )
| A. |  | B. |  | C. |  | D. |  |
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性.“钴酞菁”的分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
11.把一定量铁粉放入硫酸铁溶液中,完全反应后,所得溶液中Fe2+的浓度是Fe3+的浓度的2倍,则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 4:3 |