题目内容
17.下列说法正确的是( )| A. | Na与H2O 的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径途径a比途径b放出更多热能途径途径a:C $→_{高温}^{H_{2}O}$CO+H2 $→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$ CO2 | |
| C. | FeCl3和MnO2均可 加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| D. | Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为热能 |
分析 A、该反应为固体与液态反应生成气体,该反应为熵增反应,反应放出大量的热,结合△G=△H-T△S<0,反应自发进行;
B、化学反应的热效应只与反应物的初始状态和生成物的最终状态有关;
C、不同的催化剂催化效果不同;
D、Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为化学能和热能.
解答 解:A、Na与水反应为固体与液态反应生成气体,该反应为熵增反应,即△S>O,反应中钠熔化为小球,说明反应放出大量的热,即△H<0,则△G=△H-T△S<0,故该反应自发进行,故A正确;
B、化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,故ab两种途径,放出的热量一样多,故B错误;
C、不同的催化剂的催化效果不一定相同,所以同等条件下二者对H2O2分解速率的改变不一定相同,故C错误;
D、Mg在CO2中燃烧生成MgO和C的反应中,化学能全部转化为化学能和热能,故D错误;
故选A.
点评 本题考查了反应自发性,盖斯定律,化学反应的热效应和催化剂对化学反应速率的影响等,掌握基础是关键,题目较简单.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
7.化学与社会、生活密切相关.对下列现象或客观事实的解释正确的是( )
| 选项 | 现象或客观事实 | 解 释 |
| A | 浸泡KMnO4溶液的硅土延长果实的成熟 | 利用乙烯可以发生加成反应 |
| B | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| C | SO2能使氯水褪色 | SO2具有还原性 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
8.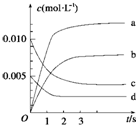 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
(1)如图表示NO2的变化的曲线是b.0~2s内,用O2表示的该反应的速率v(O2)0.0015mol•L-1•s-1
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
5.下列微粒具有氧化性的是( )
| A. | MnO4- | B. | Fe | C. | Cl- | D. | SO42- |
9.分子式为C10H12的芳香烃中,苯环上一溴代物有两种结构的物质共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.下列说法正确的是( )
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |

