题目内容
16.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应 3A(g)+B(g)═xC(g)+2D(g),经过5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的反应速率是0.1mol/(L•min).(1)x的值是2;
(2)A在5min末的浓度是0.75mol/L;
(3)B的平均反应速率是0.05mol/(L•min),A的转化率是50%.
分析 (1)计算C的浓度变化量,利用浓度变化量之比等于化学计量数之比计算x;
(2)由方程式可知△c(A)=$\frac{3}{2}$△c(D)、△c(B)=$\frac{1}{2}$△c(D),再利用5min时A、B浓度之比计算A的起始浓度,5min末A的浓度=A的起始浓度-△c(A);
(3)利用速率之比等于化学计量数之比计算v(B),转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:(1)浓度变化量之比等于化学计量数之比,则x:2=0.1mol/(L•min)×5min:0.5mol/L,解得x=2,
故答案为:2;
(2)由方程式可知△c(A)=$\frac{3}{2}$△c(D)=$\frac{3}{2}$×0.5mol/L=0.75mol/L,△c(B)=$\frac{1}{2}$△c(D)=0.25mol/L,A、B起始浓度相等设为cmol/L,则(c-0.75):(c-0.25)=3:5,解得c=1.5,故5min末A的浓度=1.5mol/L-0.75mol/L=0.75mol/L,
故答案为:0.75mol/L;
(3)速率之比等于化学计量数之比,则v(B)=$\frac{1}{2}$v(C)=0.05mol/(L•min),A的转化率=$\frac{0.75mol/L}{1.5mol/L}$×100%=50%,
故答案为:0.05mol/(L•min);50%.
点评 本题考查化学平衡有关计算,难度不大,利用三段式进行计算更为直观.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
10.已知热化学方程式:
H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
| A. | 吸热44kJ | B. | 吸热2.44KJ | C. | 放热44kJ | D. | 放热2.44KJ |
7.在日常生活中人们经常使用金属材料,以下关于金属材料的叙述正确的是( )
①青铜是人类历史上使用最早的合金
②合金的熔点一般比各成分金属熔点高.
③合金往往比纯净的金属有较好的物理、化学或机械性能
④合金的性质是各成分金属性质之和⑤铁制容器可以贮运浓硫酸、浓硝酸.
①青铜是人类历史上使用最早的合金
②合金的熔点一般比各成分金属熔点高.
③合金往往比纯净的金属有较好的物理、化学或机械性能
④合金的性质是各成分金属性质之和⑤铁制容器可以贮运浓硫酸、浓硝酸.
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①②⑤ | D. | ①②③④⑤ |
4.下列物质中氧元素的化合价正确的是( )
| A. | H2O中氧元素的化合价为-l | B. | O2中氧元素的化合价为-2 | ||
| C. | NaOH中氧元素的化合价为-2 | D. | Na2O2中氧元素的化合价为-2 |
11.向含等物质的量的FeCl3和AlCl3的混合溶液中逐滴加入NaOH溶液,如图图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的物质的量)( )
| A. |  | B. |  | C. |  | D. | 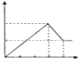 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红的溶液中:Na+、Cl-、CH3COO-、Fe2+ | |
| B. | 水电离的OH-浓度为10-12mol/L-1的溶液中:Mg2+、NH4+、AlO2-、SO32- | |
| C. | 无色溶液中:Al3+、NO3-、Cl-、SO42- | |
| D. | c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4-、Cl- |
5.下列离子方程式书写正确的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硝酸银溶液中加入铁粉:Ag++Fe═Fe2++Ag | |
| C. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| D. | 碳酸镁与稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
6.欲除去铁粉中少量的铝粉,可选用的试剂是( )
| A. | 水 | B. | 氢氧化钠溶液 | C. | 稀硫酸 | D. | 稀硝酸 |