题目内容
6.按要求完成下列问题:(1)甲基的电子式
 .
.(2)相对分子质量为72且沸点最低的烷烃的结构简式为CH3C(CH3)2CH3.
(3)甘氨酸(H2NCH2COOH)的缩聚反应的产物的结构简式
 .
.(4)
 形成六元环酯的产物的结构简式
形成六元环酯的产物的结构简式 .
.
分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;
(2)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(3)氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,通过缩水形成肽键形成高分子化合物;
(4)2-羟基丙酸CH3CH(OH)COOH,分子间酸脱羟基、醇脱氢发生酯化反成六元环酯.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为 ,故答案为:
,故答案为: ;
;
(2)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故CH3C(CH3)2CH3,
故答案为:CH3C(CH3)2CH3;
(3)甘氨酸(H2NCH2COOH)羧基提供-OH,氨基提供-H, ,缩聚反应生成产物的结构简式为:
,缩聚反应生成产物的结构简式为: ,
,
故答案为; ;
;
(4)2-羟基丙酸CH3CH(OH)COOH,发生酯化反,酸脱羟基、醇脱氢,分子间脱水形成的含六元环的化合物,反应为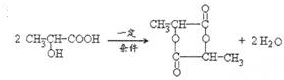 ,六元环酯结构简式为
,六元环酯结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的机构和性质,为高考常见题型,注意把握有机物的官能团的性质以及相关结构简式的书写为解答该题的关键,题目难度中等.

练习册系列答案
相关题目
17.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | |
| B. | 0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| D. | 1L0.1mol•L-1Na2CO3溶液中含有的阴离子数为0.1NA |
1.下列离子方程式不正确的是( )
| A. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | |
| B. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 醋酸溶液与新制氢氧化铜:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| D. | 乙酸与碳酸钠溶液反应:2 CH3COOH+CO32-→2CH3COO-+CO2↑+H2O |
11.下列对事实的解释不正确的是( )
| 选项 | 事实 | 解释 |
| A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
| B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
| C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法正确的是( )
| A. | 若某NaOH溶液的温度由25℃→50℃(忽略液体体积的变化),则溶液的pH将减小 | |
| B. | 25℃时,用盐酸滴等浓度的氨水至pH=7,则V(盐酸)>V(氨水) | |
| C. | 将2mol CO2通入到1L 3mol•L-1NaOH溶液中,则溶液中,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=12的Na2CO3溶液中,H+的浓度是OH-的浓度的1010倍 |
5.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Na+、SO32-、Cl- | B. | H+、Ag+、NO3-、Cl- | ||
| C. | NO3-、Fe2+、H+、Cl- | D. | S2-、Na+、CO32-、H+ |





 .
. .
.