题目内容
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)?2C(g)达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amolB;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amolB.
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amolB;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amolB.
| A、(2)(5) |
| B、(1)(3) |
| C、(2) |
| D、(5)(6) |
考点:化学平衡状态的判断
专题:
分析:当可逆反应达到平衡状态时,正逆反应速率相等,反应体现中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,据此分析解答.
解答:
解:(1)C的生成速率与C的分解速率相等时,正逆反应速率相等,所以该反应达到平衡状态,故不选;
(2)无论该反应是否达到平衡状态,单位时间内amol A生成同时生成3amolB,所以不能据此判断该反应是否达到平衡状态,故选;
(3)A、B、C的浓度不再变化时,正逆反应速率相等,该反应达到平衡状态,故不选;
(4)该反应是一个反应前后气体计量数之和改变的反应,当混合气体的总压强不再变化时,正逆反应速率相等,该反应达到平衡状态,故不选;
(5)该反应是一个反应前后气体计量数之和改变的反应,当混合气体的物质的量不再变化时,正逆反应速率相等,所以该反应达到平衡状态,故不选;
(6)单位时间消耗amol A,同时生成3amolB,该反应正逆反应速率相等,所以达到平衡状态,故不选;
故选C.
(2)无论该反应是否达到平衡状态,单位时间内amol A生成同时生成3amolB,所以不能据此判断该反应是否达到平衡状态,故选;
(3)A、B、C的浓度不再变化时,正逆反应速率相等,该反应达到平衡状态,故不选;
(4)该反应是一个反应前后气体计量数之和改变的反应,当混合气体的总压强不再变化时,正逆反应速率相等,该反应达到平衡状态,故不选;
(5)该反应是一个反应前后气体计量数之和改变的反应,当混合气体的物质的量不再变化时,正逆反应速率相等,所以该反应达到平衡状态,故不选;
(6)单位时间消耗amol A,同时生成3amolB,该反应正逆反应速率相等,所以达到平衡状态,故不选;
故选C.
点评:本题考查平衡状态的判断,只有前后改变的物理量不变时该反应才能达到平衡状态,反应前后不变的物理量不能作为判断依据,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
维生素C是一种无色晶体,溶液显酸性,广泛存在于新鲜水果和绿色蔬菜中,下列哪种食品维生素C含量较少( )
| A、白菜 | B、面筋(酿皮子) |
| C、西红柿 | D、山楂 |
铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L H2(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为( )
| A、0.1 mol |
| B、0.2 mol |
| C、0.05 mol |
| D、0.025 mol |
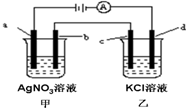 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A、乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
| B、当电解一段时间后,将甲、乙两溶液混合,一定会沉淀 |
| C、当b极增重5.4g时,d极产生的气体为2.24L(标准状况) |
| D、甲烧杯中溶液的pH降低 |
下列物质与水反应,能放出氧气的是( )
| A、Na |
| B、Na2O |
| C、Na2O2 |
| D、NO2 |
对于密闭容器中进行的反应CO(g)+H2O(g)?CO2 (g)+H2(g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是( )
| A、正反应速率增大 |
| B、逆反应速率先减小后增大 |
| C、达到平衡时,逆反应速率比原平衡要大 |
| D、CO的转化率降低 |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O═SO42-+4H++2Fe2+,Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.下列说法正确的是( )
| A、氧化性:SO2可以被Cr2O72-氧化 |
| B、还原性:Cr3+>Fe2+>SO2 |
| C、Cr2O72-在反应中做还原剂 |
| D、两个反应中Fe3+均表现还原性 |
已知氨水的密度比水小,且浓度越大密度越小.溶质的质量分数分别为5%和25%的氨水等体积混合,混合后所得溶液中溶质的质量分数是( )
| A、15% | B、<15% |
| C、>15% | D、30% |