题目内容
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,物质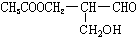 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
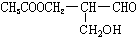 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )| A、与甲酸发生酯化反应 |
| B、与NaOH水溶液共热 |
| C、与足量的氧气作用 |
| D、在催化剂存在下与氢气作用 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,结合官能团的变化分析C连的不同基团即可解答.
解答:
解:A.与甲酸发生酯化反应,生成-CH2OOCH,C原子连接的4个原子或原子团不同,仍具有光学活性,故A正确;
B.与NaOH水溶液共热,酯基水解,得到2个-CH2OH,则不具有光学活性,故B错误;
C.如燃烧,可生成二氧化碳和水,不具有光学活性,如催化氧化羟基,可生成醛基,连接相同的原子团,不具有光学活性,故C错误;
D.-CHO与氢气发生加成生成-CH2OH,则不具有手性,不具有光学活性,故D错误.
故选A.
B.与NaOH水溶液共热,酯基水解,得到2个-CH2OH,则不具有光学活性,故B错误;
C.如燃烧,可生成二氧化碳和水,不具有光学活性,如催化氧化羟基,可生成醛基,连接相同的原子团,不具有光学活性,故C错误;
D.-CHO与氢气发生加成生成-CH2OH,则不具有手性,不具有光学活性,故D错误.
故选A.
点评:本题以手性碳考查有机物的结构与性质,注意把握醛、酯、醇的性质是解答的关键,注意体会官能团与性质的关系,题目难度不大.

练习册系列答案
相关题目
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |