题目内容
已知:3S+6KOH
2K2S+K2SO3+3H2O,在反应中被还原的硫原子与被氧化的硫原子个数比为( )
| ||
| A、1:1 | B、1:5 |
| C、1:2 | D、2:1 |
考点:氧化还原反应的计算,氧化还原反应
专题:
分析:3S+6KOH
2K2S+K2SO3+3H2O中,S元素的化合价由0升高为+4价,由0降低为-2价,以此来解答.
| ||
解答:
解:3S+6KOH
2K2S+K2SO3+3H2O中,S元素的化合价由0升高为+4价,失去电子被氧化,由0降低为-2价,则得到电子被还原,
由原子守恒可知,2molS得到电子与1molS失去电子相等,
则在反应中被还原的硫原子与被氧化的硫原子个数比为2:1,
故选D.
| ||
由原子守恒可知,2molS得到电子与1molS失去电子相等,
则在反应中被还原的硫原子与被氧化的硫原子个数比为2:1,
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中电子守恒及原子守恒的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |
下列现象不能用“相似相溶规则”原理解释的是( )
| A、氯化氢易溶于水 |
| B、氯气易溶于氢氧化钠溶液 |
| C、碘易溶于四氯化碳 |
| D、碘难溶于水 |
下列物质中不属于新型有机高分子材料的是( )
| A、高分子分离膜 |
| B、液晶高分子材料 |
| C、生物高分子材料 |
| D、有机玻璃 |
下列各组离子能在pH=1的无色溶液中大量共存的是( )
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、AlO2- |

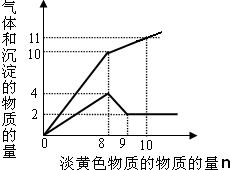 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是