题目内容
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)冶炼铝.回答下列问题:
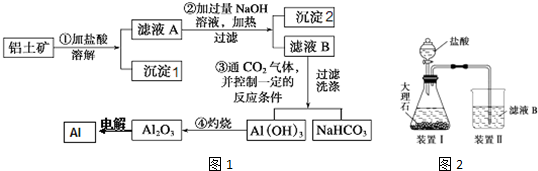
(1)在实验中需用1.0mol?L-1的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒、量筒、烧杯,还缺少的玻璃仪器是 .
(2)沉淀1的主要成份为:
(3)生成沉淀2的离子反应方程式为
(4)电解Al2O3制备Al阴极反应式为 .
(5)甲同学在实验室中用图2装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.
乙同学分析认为甲同学通入CO2不足是导致实验失败的原因之一,你认为乙的判断依据是什么?请用离子方程式解释其原因: .
(6)将Al2O3溶于KOH溶液,再加入过量的浓硫酸可得到明矾溶液,从明矾溶液中获取明矾晶体的基本操作步骤为: , ,过滤,洗涤,干燥.
(7)若铝土矿中Al2O3的含量为51%,100g 铝土矿利用上述生产流程提取出Al2O3后再用于第(6)小问中方法制备明矾,理论上最多可生产 mol KAl(SO4)2?12H2O.(提示:Al2O3的摩尔质量为102g/mol )

(1)在实验中需用1.0mol?L-1的NaOH溶液480mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒、量筒、烧杯,还缺少的玻璃仪器是
(2)沉淀1的主要成份为:
(3)生成沉淀2的离子反应方程式为
(4)电解Al2O3制备Al阴极反应式为
(5)甲同学在实验室中用图2装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.
乙同学分析认为甲同学通入CO2不足是导致实验失败的原因之一,你认为乙的判断依据是什么?请用离子方程式解释其原因:
(6)将Al2O3溶于KOH溶液,再加入过量的浓硫酸可得到明矾溶液,从明矾溶液中获取明矾晶体的基本操作步骤为:
(7)若铝土矿中Al2O3的含量为51%,100g 铝土矿利用上述生产流程提取出Al2O3后再用于第(6)小问中方法制备明矾,理论上最多可生产
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加盐酸,得到滤液A中含有铝离子、铁离子,沉淀1为二氧化硅,A溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液B中,通入二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝得到铝,
(1)依据一定物质的量浓度溶液的配制方法以及仪器的选择回答即可,
(2)铝土矿可以看做Fe2O3、Al2O3、SiO2组成,铝土矿加过量盐酸溶解后,Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,不溶物为SiO2;
(3)沉淀2为加入烧碱后的沉淀,所以沉淀为氢氧化物;
(4)根据电解原理可知阴极生成Al,阳极生成O2,以此书写电极反应式;
(5)二氧化碳不足量时,只发生CO2和NaOH的反应;
(6)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(7)根据铝守恒来计算.
(1)依据一定物质的量浓度溶液的配制方法以及仪器的选择回答即可,
(2)铝土矿可以看做Fe2O3、Al2O3、SiO2组成,铝土矿加过量盐酸溶解后,Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,不溶物为SiO2;
(3)沉淀2为加入烧碱后的沉淀,所以沉淀为氢氧化物;
(4)根据电解原理可知阴极生成Al,阳极生成O2,以此书写电极反应式;
(5)二氧化碳不足量时,只发生CO2和NaOH的反应;
(6)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(7)根据铝守恒来计算.
解答:
解:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入盐酸,得到滤液A中含有铝离子、铁离子,沉淀1为二氧化硅,A溶液加入过量氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液B中,通入二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝得到铝,
(1)在实验中需用1mol?L-1的NaOH溶液480mL,但是实验室中无480mL的容量瓶,依据“大而近”的仪器选择原则,故应选取500mL容量瓶,配制该溶液需要溶解固体,故还需要烧杯,故答案为:500mL容量瓶;
(2)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀B为不溶物SiO2;
故答案为:SiO2;
(3)滤液A中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,
所以沉淀2的成分是氢氧化铁,生成氢氧化铁的反应方程式为:Fe3++3OH-═Fe(OH)3↓;
故答案为:Fe3++3OH-═Fe(OH)3↓;
(4)根据电解原理可知阴极生成Al,电极方程式为Al3++3e-=Al,故答案为:Al3++3e-=Al;
(5)滤液中含有过量的NaOH,二氧化碳不足量时,先发生CO2和NaOH的反应,所以该同学解释合理,离子方程式为2OH-+CO2=CO32-+H2O,故答案为:合理;2OH-+CO2=CO32-+H2O;
(6)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:蒸发浓缩、冷却结晶;
(7)Al2O3~2KAl(SO4)2?12H2O
102 2mol
100g×51% n
n=
=1mol;
故答案为:1.
(1)在实验中需用1mol?L-1的NaOH溶液480mL,但是实验室中无480mL的容量瓶,依据“大而近”的仪器选择原则,故应选取500mL容量瓶,配制该溶液需要溶解固体,故还需要烧杯,故答案为:500mL容量瓶;
(2)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀B为不溶物SiO2;
故答案为:SiO2;
(3)滤液A中含有的阳离子有Fe3+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,
所以沉淀2的成分是氢氧化铁,生成氢氧化铁的反应方程式为:Fe3++3OH-═Fe(OH)3↓;
故答案为:Fe3++3OH-═Fe(OH)3↓;
(4)根据电解原理可知阴极生成Al,电极方程式为Al3++3e-=Al,故答案为:Al3++3e-=Al;
(5)滤液中含有过量的NaOH,二氧化碳不足量时,先发生CO2和NaOH的反应,所以该同学解释合理,离子方程式为2OH-+CO2=CO32-+H2O,故答案为:合理;2OH-+CO2=CO32-+H2O;
(6)从溶液中获得晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:蒸发浓缩、冷却结晶;
(7)Al2O3~2KAl(SO4)2?12H2O
102 2mol
100g×51% n
n=
| 100g×51%×2mol |
| 102 |
故答案为:1.
点评:本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度不大.

练习册系列答案
相关题目
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17.则下列有关叙述正确的是( )
| A、Y、Z和W三种元素可能位于同一周期 |
| B、Y和W所形成的含氧酸均为强酸 |
| C、X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物 |
| D、上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |

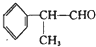
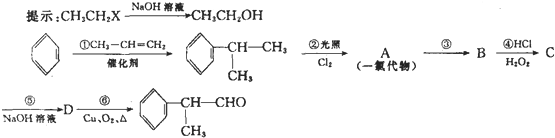


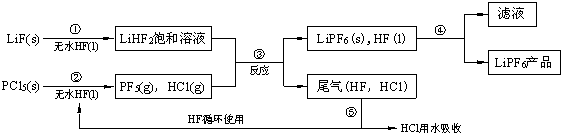
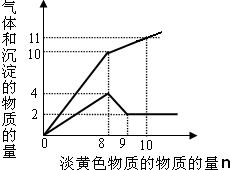 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是