题目内容
镁是一种重要的金属资源,工业上制取镁单质主要是电解法.
(1)电解法制取镁单质的反应方程式是: .
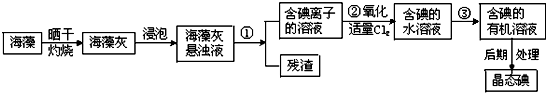
(2)电解原料无水氯化镁可由海水制备.主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
其步骤先后顺序是 ;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指: ,其目的是 .
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ mol?L-1.
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是 .反应原理可能有两方面,请分别用离子方程式表示:① ;② .
要验证①②谁是Mg(OH)2溶解的主要原因,可选取 代替NH4Cl溶液作对照实验.
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一.一种“镁-次氯酸盐”电池的总反应为:
Mg+ClO-+H2O═Mg(OH)2+Cl-.其工作时正极的电极反应式: ;用此镁电池给铅蓄电池充电,下列说法中正确的是 .
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg,阴、阳极的质量变化之比为3:2
D.充电后,镁电池和铅蓄电池的pH均增大.
(1)电解法制取镁单质的反应方程式是:
(2)电解原料无水氯化镁可由海水制备.主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
其步骤先后顺序是
(3)上述步骤①中“一定条件下”具体是指:
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是
要验证①②谁是Mg(OH)2溶解的主要原因,可选取
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一.一种“镁-次氯酸盐”电池的总反应为:
Mg+ClO-+H2O═Mg(OH)2+Cl-.其工作时正极的电极反应式:
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg,阴、阳极的质量变化之比为3:2
D.充电后,镁电池和铅蓄电池的pH均增大.
考点:电解原理,原电池和电解池的工作原理,盐类水解的应用
专题:
分析:(1)工业上制取镁单质主要是电解熔融的氯化镁;
(2)先生成氢氧化镁,氢氧化镁和盐酸反应生成氯化镁,易除去氯化钠等杂质;
(3)根据氯化镁溶液加热易水解生成挥发的氯化氢来分析;
(4)依据沉淀溶解平衡存在的溶度积常数计算得到;
(5)加入氯化铵在溶液中水解显酸性,可以溶解氢氧化镁沉淀;
(6)根据正极得电子发生还原反应书写;根据充电时正极充当阳极,负极充当阴极来分析.
(2)先生成氢氧化镁,氢氧化镁和盐酸反应生成氯化镁,易除去氯化钠等杂质;
(3)根据氯化镁溶液加热易水解生成挥发的氯化氢来分析;
(4)依据沉淀溶解平衡存在的溶度积常数计算得到;
(5)加入氯化铵在溶液中水解显酸性,可以溶解氢氧化镁沉淀;
(6)根据正极得电子发生还原反应书写;根据充电时正极充当阳极,负极充当阴极来分析.
解答:
解:(1)工业上制取镁单质主要是电解熔融的氯化镁,方程式为:MgCl2(熔融)  Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)  Mg+Cl2↑;
Mg+Cl2↑;
(2)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2?6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2?6H2O
MgCl2 +6H2O.
故答案为:②④③⑤④①;
(3)根据(2)的分析,步骤①中“一定条件下”具体是指在HCl气流中加热晶体,目的 防止加热时水合氯化镁晶体水解,故答案为:在HCl气流中加热晶体; 防止加热时水合氯化镁晶体水解;
(4)Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则Ksp=c(Mg2+)×c2(OH-)=6.4×10-12 ,c(OH-)≥8×10-4mol/L,故答案为:8×10-4;
(5)加入NH4Cl,溶解后因其能水解显酸性,NH4Cl+H2O?NH3?H2O+HCl,水解生成的盐酸会溶解氢氧化镁,从而又会造成Mg(OH)2沉淀的溶解,Mg(OH)2+2HCl=MgCl2+2H2O,所以饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,出现的现象是白色沉淀溶解;硝酸铵、硫酸铵和氯化铵相似,只有铵根离子的水解,而碳酸氢铵溶液呈碱性,只有醋酸铵呈中性并且含有铵根,故答案为:白色沉淀溶解(或溶液变澄清);①NH4++H2O NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
(6)一种“镁-次氯酸盐”电池的总反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.其工作时正极是ClO-得电子发生还原反应的反应,所以正极的电极反应式为:ClO-+2e-+H2O=Cl-+2OH-;用此镁电池给铅蓄电池充电,
A.镁电池正极充当阳极应与铅蓄电池正极相连,故A正确;
B.电子从镁电池负极转移到Pb电极,故B错误;
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg即转移2mol电子,所以阴极生成是铅、阳极生成是二氧化铅的质量变化之比为3:2,故C正确;
D.充电后,镁电池的PH值基本没有变化和铅蓄电池生成硫酸故pH减小,故D错误;
故答案为:ClO-+2e-+H2O=Cl-+2OH-; A C;
 Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)  Mg+Cl2↑;
Mg+Cl2↑;(2)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2?6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2?6H2O
| ||
故答案为:②④③⑤④①;
(3)根据(2)的分析,步骤①中“一定条件下”具体是指在HCl气流中加热晶体,目的 防止加热时水合氯化镁晶体水解,故答案为:在HCl气流中加热晶体; 防止加热时水合氯化镁晶体水解;
(4)Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则Ksp=c(Mg2+)×c2(OH-)=6.4×10-12 ,c(OH-)≥8×10-4mol/L,故答案为:8×10-4;
(5)加入NH4Cl,溶解后因其能水解显酸性,NH4Cl+H2O?NH3?H2O+HCl,水解生成的盐酸会溶解氢氧化镁,从而又会造成Mg(OH)2沉淀的溶解,Mg(OH)2+2HCl=MgCl2+2H2O,所以饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,出现的现象是白色沉淀溶解;硝酸铵、硫酸铵和氯化铵相似,只有铵根离子的水解,而碳酸氢铵溶液呈碱性,只有醋酸铵呈中性并且含有铵根,故答案为:白色沉淀溶解(或溶液变澄清);①NH4++H2O
 NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;(6)一种“镁-次氯酸盐”电池的总反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.其工作时正极是ClO-得电子发生还原反应的反应,所以正极的电极反应式为:ClO-+2e-+H2O=Cl-+2OH-;用此镁电池给铅蓄电池充电,
A.镁电池正极充当阳极应与铅蓄电池正极相连,故A正确;
B.电子从镁电池负极转移到Pb电极,故B错误;
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg即转移2mol电子,所以阴极生成是铅、阳极生成是二氧化铅的质量变化之比为3:2,故C正确;
D.充电后,镁电池的PH值基本没有变化和铅蓄电池生成硫酸故pH减小,故D错误;
故答案为:ClO-+2e-+H2O=Cl-+2OH-; A C;
点评:本题考查了金属镁的提取原理及其镁化合物的性质、原电池、电解池的知识,该考点是高考考查的重点和难点,本题有一定的综合性,难度适中.

练习册系列答案
相关题目
下列说法正确的是( )
| A、小苏打是弱电解质,其水溶液导电能力很弱 |
| B、氨气是非电解质,但氨水能导电 |
| C、稀释醋酸溶液,可以促进醋酸分子电离使溶液pH减小 |
| D、硫酸是强电解质,在水溶液和熔融状态下均能导电 |
大量事实证明,水溶液中并不存在H+、AlO2-等离子,实际存在的是H30+、[Al(OH)4]-.铝和强碱溶液的反应可以理解为铝在碱性环境下先与水反应,而后进一步与强碱反应(反应均不可逆).对于Al与重氢氧化钠(NaOD)的水溶液反应(假定水中不含氘和氚),下列说法正确的是( )
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
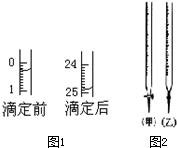 某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.
某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.