题目内容
下列说法正确的是( )
| A、小苏打是弱电解质,其水溶液导电能力很弱 |
| B、氨气是非电解质,但氨水能导电 |
| C、稀释醋酸溶液,可以促进醋酸分子电离使溶液pH减小 |
| D、硫酸是强电解质,在水溶液和熔融状态下均能导电 |
考点:强电解质和弱电解质的概念,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、小苏打是碳酸钠属于盐;
B、氨气溶于水生成一水合氨,电离出铵根和氢氧根离子,所以氨水可以导电,但氨气是非电解质;
C、越稀越电离;
D、依据电解质是水溶液中或熔融状态能导电的化合物分析.
B、氨气溶于水生成一水合氨,电离出铵根和氢氧根离子,所以氨水可以导电,但氨气是非电解质;
C、越稀越电离;
D、依据电解质是水溶液中或熔融状态能导电的化合物分析.
解答:
解:A、小苏打是碳酸钠属于盐,是强电解质,故A错误;
B、氨气溶于水生成一水合氨,电离出铵根和氢氧根离子,所以氨水可以导电,但氨气是非电解质,故B正确;
C、稀释醋酸溶液时,根据越稀越电离,所以电离平衡向电离方向移动,但氢离子浓度仍然变小,则PH增大,故C错误;
D、电解质是水溶液中或熔融状态能导电的化合物,硫酸是强电解质,但在熔融状态下不导电,故D错误;
故选B.
B、氨气溶于水生成一水合氨,电离出铵根和氢氧根离子,所以氨水可以导电,但氨气是非电解质,故B正确;
C、稀释醋酸溶液时,根据越稀越电离,所以电离平衡向电离方向移动,但氢离子浓度仍然变小,则PH增大,故C错误;
D、电解质是水溶液中或熔融状态能导电的化合物,硫酸是强电解质,但在熔融状态下不导电,故D错误;
故选B.
点评:本题考查了电解质概念的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则下列说法正确的是( )
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
下列说法不正确的是( )
| A、从HCl、HBr到HI的熔点沸点升高与范德华力大小有关 |
B、CO的一种等电子体为NO+,它的电子式为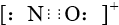 |
| C、H2O的熔点沸点大于H2S,是由于H2O分子之间存在氢键这种化学键 |
| D、电子层序数越大,s原子轨道的形状相同、半径越大 |
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质.
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
下列电离方程式正确的是( )
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |