题目内容
3.由氧气与氢气反应生成1摩尔液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )| A. | 2H2+O2=2H2O+285.75KJ | B. | 2H2(g)+O2 (g)=2H2O(l)+571.5KJ | ||
| C. | H2(g)+O2(g)=H2O(g)+285.75KJ | D. | H2 (g)+O2(g)=H2O(l)-285.75KJ |
分析 生成1摩尔液态水放出285.75KJ热量,则生成2mol液态水放热热量为285.75KJ×2=571.5KJ,结合物质的状态及焓变来解答.
解答 解:生成1摩尔液态水放出285.75KJ热量,则生成2mol液态水放热热量为285.75KJ×2=571.5KJ,可知热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)+285.75KJ或2H2(g)+O2 (g)=2H2O(l)+571.5KJ,或H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.75KJ/mol或2H2(g)+O2 (g)=2H2O(l)△H=-571.5KJ/mol,
故选B.
点评 本题考查热化学方程式,为高频考点,把握物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意热化学方程式中物质的状态及能量变化,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.下列有关叙述正确的是( )
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得2015年诺贝尔生理学、医学奖屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
11.镍铬(Ni-Cd)可充电电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2;已知Ni(OH)2、Cd(OH)2和NiOOH都不溶于KOH溶液.则下列有关电极反应式或说法正确的是( )
| A. | 放电时负极:Cd-2e-═Cd2+ | |
| B. | 放电时正极:2NiOOH+2e-+2H2O═2Ni(OH)2+2OH- | |
| C. | 充电时阳极:2Ni(OH)2-2e-+4H+═2Ni3++4H2O | |
| D. | 充电时含Cd的电极应与电源的正极相连 |
18.下列化学用语对应正确的是( )
| A. | CH4分子的比例模型: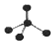 | B. | 乙酸的化学式:C2H4O2 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | F-的结构示意图: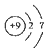 |
8.下列各组中的离子,因发生氧化还原反应而不能大量共存同一溶液中的是( )
| A. | Fe2+、SO42-、Fe3+、Cl- | B. | S2-、Cu2+、Na+、Cl- | ||
| C. | H+、SO42-、Cu2+、OH- | D. | Fe2+、H+、Mg2+、NO3- |
15.巴豆酸是一种对肠胃道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3-CH=CH-COOH.根据巴豆酸结构特点,判断下列说法正确的是( )
| A. | 巴豆酸能使溴的CCl4溶液褪色 | |
| B. | 巴豆酸不能使酸性KMnO4溶液褪色 | |
| C. | 1mol巴豆酸能与2molH2发生加成反应 | |
| D. | 巴豆酸能与CH3CH2OH发生取代反应 |
13.下列有关说法中,正确的是( )
| A. | 工业上利用铝热反应炼铁 | |
| B. | 将Mg、Al用导线连接并插入NaOH溶液中,判断Mg、Al金属性强弱 | |
| C. | 将CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀 | |
| D. | 实验室利用锌片和稀硫酸制H2时,为了加快制H2的反应速率可加入Cu(NO3)2 |