题目内容
14.同学小明上完氯气性质一节仍感意犹未尽,自己又在老师的指导下做了氯气与金属铝的反应,实验前老师要求他查一下氯化铝的相关理化数据,他发现氯化铝的熔点为190℃(2.02×105 Pa),而沸点是180℃(1)常压下持续加热AlCl3,AlCl3会升华(填物理变化过程)
(2)根据这些数据,可以推测氧化铝是分子晶体,可进一步验证这个结论的是:A.
A.熔融氯化铝不导电 B.氯化铝溶液可导电
C.氯化铝温室下为固体 D.氢氧化铝溶于盐酸可生成氯化铝
(3)又查得,氯化铝蒸气的密度(换算成标准状况时)为11.92g•L-1,氯化铝的化学式为Al2Cl6.
分析 (1)在2.02×105 Pa,AlCl3的沸点是180℃,所以常压下持续加热AlCl3会 升华;
(2)发现氯化铝的熔点为190℃(2.02×105 Pa),而沸点是180℃,所以常压下氯化铝的熔沸点低,则氯化铝是分子晶体;分子晶体在熔融状态下不导电;
(3)根据密度计算摩尔质量,确定分子式.
解答 解:(1)在2.02×105 Pa,AlCl3的沸点是180℃,所以常压下氯化铝的沸点更低,持续加热AlCl3会 升华,故答案为:升华;
(2)发现氯化铝的熔点为190℃(2.02×105 Pa),而沸点是180℃,所以常压下氯化铝的熔沸点低,则氯化铝是分子晶体;证明氯化铝是分子晶体的方法是熔融状态下氯化铝不导电,所以选A,故答案为:分子;A;
(3)Al显示+3价,则氯化铝可写为(AlCl3)n,M=ρ•vm,M=11.92g•L-1×22.4L•mol-1=267g/mol,n=$\frac{267}{133.5}$=2,化学式为Al2Cl6,
故答案为:Al2Cl6.
点评 本题考查分子结构、晶体类型的判断等,难度中等,由晶体的密度求分子式对学生的思维能力、空间想象能力有一定的要求.

练习册系列答案
相关题目
20.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气体 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 元素B的单质可被热的浓硫酸或浓硝酸氧化 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
1.X、Y、Z是3种原子序数逐渐增大的短周期元素,其中X、Y位于同一主族,X原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | 化合物YZ2中各原子都达到8电子结构 | |
| C. | 这3种元素的氢化物的沸点由高到低的顺序为:Z>Y>X | |
| D. | 其对应的阴离子半径由大到小的顺序为:Z>Y>X |
19.某种氢氧燃料电池的电解质溶液为KOH溶液.下列有关该电池的叙述不正确的是( )
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应式为:2H2+O2═2H2O | |
| D. | 该电池工作时每消耗1molO2,有2mol电子转移 |
6.下列有关NO2的说法正确的是( )
| A. | NO2可由N2与O2反应直接制备 | |
| B. | NO2有毒,但因其易溶于水且与水反应,因此不属于大气污染物 | |
| C. | NO2既有氧化性也有还原性 | |
| D. | NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色 |
3.由氧气与氢气反应生成1摩尔液态水放出285.75KJ热量,下列热化学方程式书写正确的是( )
| A. | 2H2+O2=2H2O+285.75KJ | B. | 2H2(g)+O2 (g)=2H2O(l)+571.5KJ | ||
| C. | H2(g)+O2(g)=H2O(g)+285.75KJ | D. | H2 (g)+O2(g)=H2O(l)-285.75KJ |
4.工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂.但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L.某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如图,夹持仪器省略.
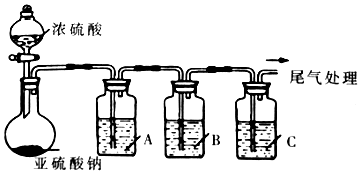
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
②A中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++4H++SO42-.
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.

(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等.
①请完成下列表格
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去.该方案是否合理否.(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为生成蓝色沉淀.
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性.该方案的不妥之处可能为高锰酸钾用硫酸酸化.
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量.取50.00ml葡萄酒样品于250mL碘量瓶中.加入少量碎冰块,再加入1mL淀粉指示液,10mL硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为VmL.以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml.该葡萄酒中SO2含量计算式为$\frac{c(V-{V}_{0})×64}{50}$g/L.
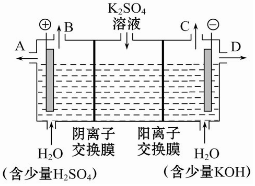 如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.