题目内容
6.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y强的是( )| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X-的还原性比Y-弱 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
分析 根据单质之间的置换反应、气态氢化物的稳定性、最高价含氧酸的酸性、与氢化合的难易、元素周期律等来比较非金属性,以此来解答.
解答 解:A.X原子的电子层数比Y原子的电子层数多,同主族元素电子层越多非金属性越弱,则Y的非金属性强,故A不选;
B.氢化物的沸点属于物理性质,不能根据氢化物的沸点判断非金属性,故B不选;
C.简单阴离子的还原性越强,其元素的非金属性越弱,X-的还原性比Y-弱,则X的非金属性强,故C选;
D.Y的单质能将X从NaX的溶液中置换出来,则Y的非金属性强,故D不选;
故选C.
点评 本题考查非金属性的比较,注意归纳非金属性比较的方法是解答的关键,明确同主族元素性质的变化规律即可解答,题目难度不大.

练习册系列答案
相关题目
16.下列有关化学用语表示正确的是( )
| A. | 水分子的比例模型: | B. | F-的结构示意图: | ||
| C. | CO2的结构式:O-C-O | D. | 中子数为8的碳原子: |
17.可用于鉴别以下三种化合物的一组试剂是( )
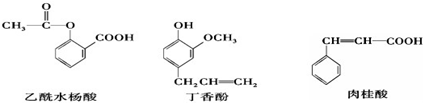
①溴的四氯化碳溶液 ②银氨溶液 ③三氯化铁溶液 ④氢氧化钠溶液.

①溴的四氯化碳溶液 ②银氨溶液 ③三氯化铁溶液 ④氢氧化钠溶液.
| A. | ②④ | B. | ①③ | C. | ③④ | D. | ①② |
14.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 0.1mol氧气参加反应得到电子的数目一定为0.4NA | |
| D. | 常温下,1L0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
1.Q、W、X、Y、Z是原子序数依次增大的短周期主族元素,Q、Y在周期表中相对位置如下:
已知:Q元素最低负化合价的绝对值与其原子最外层电子数相等,W、Y同主族,X是地壳中含量最多的金属元素.下列说法正确的是( )
| Q | ||||
| Y |
| A. | Q的最高价氧化物属于离子化合物 | |
| B. | W和氢元素组成的化合物分子中只含有极性共价键 | |
| C. | Q、X、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 | |
| D. | 工业上可用电解熔融的X的氯化物方法来制备X单质 |
11.下列说法中,正确的是( )
| A. | 多糖是很多个单糖分子按照一定的方式,通过分子内脱水而结合成的 | |
| B. | 多糖在性质上跟单糖、双糖不同,通常不溶于水,没有甜味,没有还原性 | |
| C. | 淀粉和纤维素都是重要的多糖,它们的通式都是(C6H10O5)n,二者互为同分异构体 | |
| D. | 淀粉在稀H2SO4作用下水解最后生成葡萄糖和果糖 |
18.下列关于乙酸的说法中,正确的是( )
①乙酸易溶于水和乙醇,其水溶液能导电 ②无水乙酸又称为冰醋酸,它是纯净物 ③乙酸分子里有四个氢原子,所以它不是一元酸 ④乙酸是一种重要的有机酸,常温下乙酸是有刺激性气味的液体 ⑤1mol乙酸与足量乙醇在浓硫酸作用下可生成88g乙酸乙酯 ⑥食醋中含有乙酸,乙酸可由乙醇氧化得到.
①乙酸易溶于水和乙醇,其水溶液能导电 ②无水乙酸又称为冰醋酸,它是纯净物 ③乙酸分子里有四个氢原子,所以它不是一元酸 ④乙酸是一种重要的有机酸,常温下乙酸是有刺激性气味的液体 ⑤1mol乙酸与足量乙醇在浓硫酸作用下可生成88g乙酸乙酯 ⑥食醋中含有乙酸,乙酸可由乙醇氧化得到.
| A. | ①②③④ | B. | ①②③⑥ | C. | ①②④⑥ | D. | ②④⑤ |
4.下列关于物质性质或检验的叙述不正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,不能证明原溶液中一定有Fe3+,无Fe2+ | |
| B. | 气体通过湿润的红色石蕊试纸,试纸变蓝,证明原气体中一定含有氨气 | |
| C. | 用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中一定有Na+,可能有K+ | |
| D. | 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |