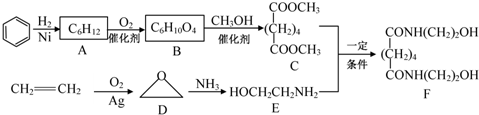
题目内容
14.设NA是阿伏加德罗常数的数值.下列说法正确的是( )| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 0.1mol氧气参加反应得到电子的数目一定为0.4NA | |
| D. | 常温下,1L0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,NA个氢氧化铁胶粒氢氧化铁的物质的量大于1mol;
B、求出D3O+的物质的量,然后根据1molD3O+中含10mol电子来分析;
C、氧气反应后的价态可能变为-1价,也可能变为-2价;
D、碳酸根的水解会导致溶液中阴离子个数增多.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,NA个氢氧化铁胶粒氢氧化铁的物质的量大于1mol,故1mol氢氧化铁胶粒的质量多于107g,故A错误;
B、19gD3O+的物质的量为n=$\frac{19g}{22g/mol}$=$\frac{19}{22}$mol,而1molD3O+中含10mol电子,故$\frac{19}{22}$molD3O+中含$\frac{190}{22}$NA个电子,故B错误;
C、氧气反应后的价态可能变为-1价,也可能变为-2价,故0.1mol氧气反应后得到的电子数不一定是0.4NA个,还可能为0.2NA个,故C错误;
D、碳酸根会水解:CO32-+2H2O?HCO3-+OH-,碳酸根的水解会导致溶液中阴离子个数增多,则溶液中的阴离子的个数多于0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.某导电性塑料的结构如图所示,合成该塑料的单体为( )

| A. | 乙炔 | B. | 乙烯 | C. | 乙烷 | D. | 甲烷 |
9.下列气体中,对人体无毒害作用的是( )
| A. | Cl2 | B. | N2 | C. | CO | D. | NO2 |
19.某原电池结构如图所示,下列有关该装置的说法正确的是( )


| A. | 将电能转换成化学能 | |
| B. | 碳棒上发生氧化反应 | |
| C. | 溶液中Cl-向铜棒一极移动 | |
| D. | 发生的总反应为:3Cu+2Fe3+═2Fe+3Cu2+ |
6.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y强的是( )
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X-的还原性比Y-弱 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
12.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( )
| A. | 元素Y、W的简单阴离子具有相同的电子层结构 | |
| B. | 由X、W两种元素组成的化合物是离子化合物 | |
| C. | X的简单气态氢化物的热稳定性比W的强是因为X的氢化物分子间易形成氢键 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
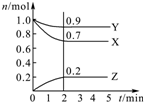 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得: