题目内容
HPE是合成除草剂的重要中间体,其结构简式如图所示.有关HPE的说法正确的是( )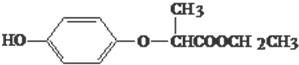

| A、HPE不能跟浓溴水反应 |
| B、1molHPE最多可以和2mol NaOH反应 |
| C、HPE在核磁共振氢谱中有6个峰 |
| D、HPE分子中有2个手性碳原子 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:该物质含酚-OH、-COOC,含7种位置的H原子,结合酚、酯的性质来解答.
解答:
解:A.含有酚-OH,能跟浓溴水发生取代反应,故A错误;
B.含酚-OH、-COOC,均能与碱反应,则1molHPE最多可以和2molNaOH反应,故B正确;
C.由结构可知,含7种位置的H原子,HPE在核磁共振氢谱中有7种,故C错误;
D.连4个不同基团的C原子为手性碳原子,则只有1个手性碳原子(-O-CH-),故D错误;
故选B.
B.含酚-OH、-COOC,均能与碱反应,则1molHPE最多可以和2molNaOH反应,故B正确;
C.由结构可知,含7种位置的H原子,HPE在核磁共振氢谱中有7种,故C错误;
D.连4个不同基团的C原子为手性碳原子,则只有1个手性碳原子(-O-CH-),故D错误;
故选B.
点评:本题考查有机物的结构与性质,为高频考点,注意体会官能团与性质的关系,明确酚、酯的性质及手性碳原子的判断即可解答,题目难度不大.

练习册系列答案
相关题目
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 下列关于该反应的叙述不正确的是( )
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
下列离子方程式书写正确的是( )
| A、石灰水与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | ||||
B、NH4HSO4溶液与足量的NaOH溶液混合加热:NH4++HSO4-+2OH-
| ||||
| C、二氧化硫通入氯化铁溶液:SO2+Fe3++2H2O═SO42-+Fe2++4H+ | ||||
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

| A、利用过滤的方法,可将Z中固体与液体分离 |
| B、X、Z烧杯中分散质相同 |
| C、Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3 CO2↑+3 Ca2+ |
| D、Z中分散系能产生丁达尔效应 |
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称.茶多酚中的活性物质没食子儿茶素(EGC)具解毒和抗辐射作用,能有效地阻止放射性物质侵入骨髓,其结构如图所示.关于EGC的下列叙述中正确的是:( )

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
下列事实不能用勒夏特列原理解释的是( )
| A、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| B、高压比常压有利于合成SO3的反应 |
| C、红棕色的NO2,加压后颜色先变深后变浅 |
| D、黄绿色的氯水光照后颜色变浅 |
 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1、T3温度时达到化学平衡 |
| B、该反应在T1温度时达到化学平衡 |
| C、该反应为放热反应 |
| D、升高温度,平衡会向正反应方向移动 |

