题目内容
气体摩尔体积与阿伏加德罗定律比较(把下列①~⑦填入下表相应空格中,填序号)
①0℃,1.01×105Pa ②相同数目分子③气体 ④同温同压 ⑤体积相同 ⑥1mol ⑦约为22.4L ⑧任何物质.
| 标准状况下的气体摩尔体积 | 阿伏加德罗定律 | |
| 研究对象 | ||
| 温度压强 | ||
| 微粒的量 | ||
| 气体体积 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:标况下的气体摩尔体积为22.4L/mol,只要是标准状况下,1mol气体所占的体积约为22.4L;
阿伏伽德罗定律为:在相同温度和压强下,相同体积的任何气体都含有相同数目的分子,
根据以上知识进行解答.
阿伏伽德罗定律为:在相同温度和压强下,相同体积的任何气体都含有相同数目的分子,
根据以上知识进行解答.
解答:
解:标况下的气体摩尔体积和阿伏伽德罗常数的研究对象都是:③气体;
标况下的气体摩尔体积的温度和压强为:①0℃,1.01×105Pa,阿伏伽德罗定律的温度和压强为:④同温同压;
标况下的气体摩尔体积的微粒的量为:⑥1mol,阿伏伽德罗定律的微粒的量为:②相同数目分子;
标况下的气体摩尔体积中气体的体积为:⑦约为22.4L,阿伏伽德罗定律的气体体积为:⑤体积相同,
故答案为:
.
标况下的气体摩尔体积的温度和压强为:①0℃,1.01×105Pa,阿伏伽德罗定律的温度和压强为:④同温同压;
标况下的气体摩尔体积的微粒的量为:⑥1mol,阿伏伽德罗定律的微粒的量为:②相同数目分子;
标况下的气体摩尔体积中气体的体积为:⑦约为22.4L,阿伏伽德罗定律的气体体积为:⑤体积相同,
故答案为:
| 标准状况下的气体摩尔体积 | 阿伏加德罗定律 | |
| 研究对象 | ③ | ③ |
| 温度压强 | ① | ④ |
| 微粒的量 | ⑥ | ② |
| 气体体积 | ⑦ | ⑤ |
点评:本题考查了标况下气体摩尔体积与阿伏伽德罗定律的比较,题目难度不大,注意掌握标况下气体摩尔体积、阿伏伽德罗定律的概念、内容,明确二者的研究对象、温度压强、气体体积、微粒的量,试题侧重考查了学生对基础知识的掌握情况.

练习册系列答案
相关题目
下列说法正确的是( )
| A、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| B、需要加热方能发生一定是吸热反应 |
| C、若反应X+Y═M是放热反应,该反应一定不用加热 |
D、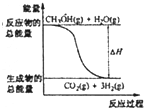 CH3OH(g)+H2O(g)═CO2(g)+3H2(g)反应能量变化如图所示,CH3OH转变H2的过程要吸收能量 |
在碳原子数小于等于10的烷烃中,其一卤代物只有一种结构的烷烃有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
 实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.
