题目内容
17.如图为各单质与化合物之间的转化关系,单质及化合物的组成元素均为常见的短周期元素.请回答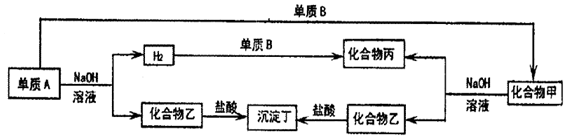
(1)若沉淀丁不溶于过量的盐酸,甲为SiO2,乙为Na2SiO3.若沉淀丁能溶于过量的盐酸,乙为NaAlO2.
(2)单质B的化学式为O2,
(3)若沉淀丁不溶于过量的盐酸,写出A和NaOH溶液反应的化学方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑.
分析 常见能与氢氧化钠溶液反应生成氢气的有Si和Al,且生成的化合物乙能与盐酸反应生成沉淀,则A应为Si,乙为Na2SiO3,丁为H2SiO3,化合物甲也能与NaOH溶液反应生成Na2SiO3,则应为SiO2,则可知丙为H2O,B为O2,如沉淀丁溶于过量盐酸时,A应为Al,乙为NaAlO2,丁为Al(OH)3,甲为Al2O3,结合对应物质的性质以及题目要求解答该题
解答 解:常见能与氢氧化钠溶液反应生成氢气的有Si和Al,且生成的化合物乙能与盐酸反应生成沉淀,则A应为Si,乙为Na2SiO3,丁为H2SiO3,化合物甲也能与NaOH溶液反应生成Na2SiO3,则应为SiO2,则可知丙为H2O,B为O2,如沉淀丁溶于过量盐酸时,A应为Al,乙为NaAlO2,丁为Al(OH)3,甲为Al2O3,
(1)由以上分析可知甲为SiO2,乙为Na2SiO3,若沉淀丁能溶于过量的盐酸,可知乙应为NaAlO2,
故答案为:SiO2;Na2SiO3;NaAlO2;
(2)B为O2,故答案为:O2;
(3)若沉淀丁不溶于过量的盐酸,丁为H2SiO3,A应为Si,乙为Na2SiO3,Si和NaOH溶液反应的方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,为高考常见题型,注意题中A与氢氧化钠溶液反应生成氢气的特点,为解答该题的突破口,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说正确的是( )
| A. | 物质的量就是1摩尔物质的质量 | B. | 1 mol水中含有2 mol氢和1 mol氧 | ||
| C. | 1 molH2中含有6.02个氢分子 | D. | NH3的摩尔质量是17g•mol-1 |
8.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A. | 将过量稀盐酸加入铁粉中,充分反应 | 有气体生成,溶液呈黄色 | 稀盐酸将Fe氧化为Fe3+ |
| B. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D. | 把一小块钠放在坩埚里加热 | 钠先熔化,发出黄色火焰最后生成淡黄色固体 | 生成了Na2O2 |
| A. | A | B. | B | C. | C | D. | D |
12.下列实验能成功的是( )
| A. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 | |
| B. | 苯和浓溴水反应制溴苯 | |
| C. | CH3CH2Br中加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 将乙酸和乙醇混合加热制乙酸乙酯 |
2.化学在生产和生活中有重要的应用,下列说法不正确的是( )
| A. | 小苏打在生活中可用做发酵粉 | |
| B. | 硅胶可用作食品中的干燥剂 | |
| C. | 可溶性铁盐或铝盐可用于净水 | |
| D. | 二氧化硅可用于制作硅芯片和光导纤维 |
6.用价层电子对互斥理论预测H2O和BF3的立体结构,两个结论都正确的是( )
| A. | 直线形,三角锥形 | B. | V形,三角锥形 | ||
| C. | 直线形,正四面体形 | D. | V形,平面三角形 |
7.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为22.X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍.下列说法正确的是( )
| A. | 原子半径:W>R>Z | |
| B. | R的最高价氧化物的水化物酸性比W的强 | |
| C. | 气态氢化物的热稳定性:Y>W>R | |
| D. | W与X形成的是离子化合物 |