题目内容
13.下列说法不正确的是( )| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol•L-1的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO$_4^-$+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A.若醋酸过量,溶于呈酸性,氢离子浓度可能大于钠离子,能够满足该离子浓度关系;
B.醋酸为弱酸,稀释后醋酸溶液中氢离子浓度较大;
C.酸性高锰酸钾能够氧化氯离子,干扰了实验结果;
D.根据混合液中的物料守恒判断.
解答 解:A.25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,当氢氧化钠较少时,钠离子浓度小于氢离子浓度,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故A正确;
B.取c(H+)=0.01mol•L-1的盐酸和醋酸,醋酸的浓度较大,将100mL两溶液分别稀释2倍后,醋酸的电离程度增大,则稀释后醋酸溶液中氢离子浓度较大,加入0.03g锌粉后在相同条件下充分反应,醋酸与锌反应的速率大,故B正确;
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,由于酸性高锰酸钾溶液能够氧化氯离子,干扰了实验,不能证明H2O2具有还原性,故C错误;
D.含等物质的量的NaHC2O4和Na2C2O4的溶液中,根据物料守恒可得:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离平衡、电荷守恒、物料守恒等知识,C为易错点,注意酸性高锰酸钾溶液能够氧化氯离子,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.已知R元素的原子有三个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为( )
| A. | 硫 | B. | 碳 | C. | 磷 | D. | 硅 |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24 L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移的电子数为NA |
8.某元素R原子的核电荷数在1~18之间,已知R2-的核外有x个电子,则R原子的核内质子数及与钠化合时的化学式分别是( )
| A. | x-2,NaR | B. | 2x,NaR | C. | x-2,Na2R | D. | x+2,Na2R |
18.下列说法正确的是( )


| A. | 帕拉米韦(结构如图)是国家药监局批准的抗H7N9流感的药品,该药品分子中含有氨基、羧基、羟基、醛基等官能团 | |
| B. | 液化石油气、汽油、沥青和石蜡的主要成分都是碳氢化合物 | |
| C. | 镧合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 石油分馏、煤的气化、海水制食盐、纤维素加工等过程都包含化学变化 |
2.下列有关天然有机物水解的叙述正确的是( )
| A. | 油脂水解均可得到葡萄糖 | B. | 可用碘检验淀粉是否完全水解 | ||
| C. | 蛋白质水解可得到高级脂肪酸 | D. | 纤维素在人和动物体内都可水解 |

 .
. 2015年的天津爆炸事故中,因爆炸冲击导致部分剧毒物质氰化钠(NaCN)泄漏,政府成立专门处置小组,通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.
2015年的天津爆炸事故中,因爆炸冲击导致部分剧毒物质氰化钠(NaCN)泄漏,政府成立专门处置小组,通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染.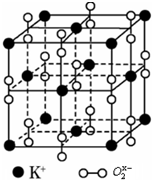 如图是钾、氧元素形成晶体的一个晶胞,晶体中氧元素以O2x-离子形式存在.
如图是钾、氧元素形成晶体的一个晶胞,晶体中氧元素以O2x-离子形式存在.