题目内容
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
(1)从上述五种元素中,两两组合能形成多种原子数之比为1:1的化合物,请写出原子数之比为1:1的既含离子键又含非极性键的化合物的电子式 ;它与空气中CO2的反应属于 (填“放热”或“吸热”) 反应;
(2)D和E非金属性较弱的是(填元素名称): ;用一个置换反应证实这一结论: ;
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,两极分别通入A单质和B单质.写出该电池的负极电极反应式: .
(1)从上述五种元素中,两两组合能形成多种原子数之比为1:1的化合物,请写出原子数之比为1:1的既含离子键又含非极性键的化合物的电子式
(2)D和E非金属性较弱的是(填元素名称):
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,两极分别通入A单质和B单质.写出该电池的负极电极反应式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素,则B为O元素;
B、D是同主族元素,则D为S;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,故A、C两元素原子核内质子数之和为12,A、C是同主族元素,则A、C不会为2、3周期的同主族元素,可推知A为H,C为Na;同周期的C、D、E三种元素中,E的原子半径最小,则E为Cl,据此进行解答.
B、D是同主族元素,则D为S;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,故A、C两元素原子核内质子数之和为12,A、C是同主族元素,则A、C不会为2、3周期的同主族元素,可推知A为H,C为Na;同周期的C、D、E三种元素中,E的原子半径最小,则E为Cl,据此进行解答.
解答:
解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素,则B为O元素;B、D是同主族元素,则D为S;B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,故A、C两元素原子核内质子数之和为12,A、C是同主族元素,则A、C不会为2、3周期的同主族元素,可推知A为H,C为Na;同周期的C、D、E三种元素中,E的原子半径最小,则E为Cl,
(1)上述五种元素中,两两组合形成原子数之比为1:1的即含离子键又含非极性键的化合物Na2O2,过氧化钠中存在氧氧非极性键和钠离子与过氧根离子之间形成的离子键,过氧化钠的电子式为: ;过氧化钠与二氧化碳的反应为放热反应,
;过氧化钠与二氧化碳的反应为放热反应,
故答案为: ;放热;
;放热;
(2)同周期随原子序数增大非金属性增强,故非金属性Cl>S,置换反应Cl2+H2S=S↓+2HCl可以证明Cl的非金属性比S强,
故答案为:硫;Cl2+H2S=S↓+2HCl;
(3)用氢气和氧气可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,负极发生氧化反应,氢气在负极上失去电子,碱性条件下生成水,负极电极反应式为:H2+2OH-+2e-=2H2O,
故答案为:H2+2OH-+2e-=2H2O.
(1)上述五种元素中,两两组合形成原子数之比为1:1的即含离子键又含非极性键的化合物Na2O2,过氧化钠中存在氧氧非极性键和钠离子与过氧根离子之间形成的离子键,过氧化钠的电子式为:
 ;过氧化钠与二氧化碳的反应为放热反应,
;过氧化钠与二氧化碳的反应为放热反应,故答案为:
 ;放热;
;放热;(2)同周期随原子序数增大非金属性增强,故非金属性Cl>S,置换反应Cl2+H2S=S↓+2HCl可以证明Cl的非金属性比S强,
故答案为:硫;Cl2+H2S=S↓+2HCl;
(3)用氢气和氧气可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液中,负极发生氧化反应,氢气在负极上失去电子,碱性条件下生成水,负极电极反应式为:H2+2OH-+2e-=2H2O,
故答案为:H2+2OH-+2e-=2H2O.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握常见化学用语的概念及书写原则,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③水 ④墨水,能观察到丁达尔效应的是( )
| A、①② | B、③④ | C、①④ | D、②④ |
A、B、C、D、E 是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性 B>A,C 和 D 的气态氢化物的稳定性 C>D;E 是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
| A、A B C D E |
| B、E C D B A |
| C、B A D C E |
| D、C D A B E |
用下列实验装置进行相应实验,能达到实验目的是( )
A、 用如图所示装置验证浓硫酸具有强氧化性 |
B、 用如图所示装置制取干燥的NH3 |
C、 用如图所示装置制取并收集乙烯 |
D、 用如图所示装置制取Cl2 |
 为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:
为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则: )的化合物
)的化合物 (R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯
(R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯 反应生成有机酸酯,例如
反应生成有机酸酯,例如


 .写出以物质C为原料制备聚乳酸(
.写出以物质C为原料制备聚乳酸( )的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH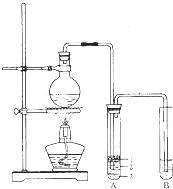 实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: