题目内容
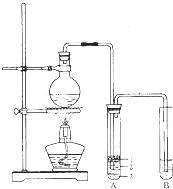 实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:(1)圆底烧瓶中加入的反应物是溴化钠、乙醇和1:1的硫酸.配制体积比1:1的硫酸所用的定量仪器为
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是
试管A中的物质分为三层(如图所示),产物在第
(4)试管A中除了产物和水之外,还可能存在
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是
a.蒸馏 b.氢氧化钠溶液洗涤c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤.
考点:溴乙烷的制取
专题:
分析:(1)根据仪器的使用方法和实验的目的来选择所需仪器;
(2)根据物质的性质进行书写反应的化学方程式;
(3)根据实验仪器的特点和有机物的性质来分析;
(4)根据HBr和CH3CH2OH都易挥发来分析;
(5)根据反应过程中生成的单质溴具有强氧化性进行分析.
(2)根据物质的性质进行书写反应的化学方程式;
(3)根据实验仪器的特点和有机物的性质来分析;
(4)根据HBr和CH3CH2OH都易挥发来分析;
(5)根据反应过程中生成的单质溴具有强氧化性进行分析.
解答:
解:(1)此实验量取溶液的体积要求精确度不是很高,可用量筒量取,故答案为:b;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,反应的化学方程式为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
CH3CH2Br+H2O;
故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
CH3CH2Br+H2O;
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故答案为:冷却、液封溴乙烷;3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确,
故答案为:d.
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,反应的化学方程式为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
| △ |
故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH
| △ |
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故答案为:冷却、液封溴乙烷;3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确,
故答案为:d.
点评:本题主要考察溴乙烷的制备、提纯、有机反应等复杂性以及实验安全等,掌握相关物质的基本化学性质熟悉该装置和反应原理是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.

练习册系列答案
相关题目
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为2 M?N |
| B、t2时,正逆反应速率相等达到平衡状态 |
| C、t1时,N的浓度是M浓度的2倍 |
| D、t3时,正反应速率大于逆反应速率 |

