题目内容
20.过二硫酸及其盐具有强氧化性,根据所学知识回答下列问题:(1)过二硫酸可看作是H2O2中氢原子被-SO3H取代的产物,其结构简式为
 ,H2O2的电子式为
,H2O2的电子式为 ,过二硫酸中氧元素的化合价为-1、-2价.
,过二硫酸中氧元素的化合价为-1、-2价.(2)在酸性条件下,K2S2O8溶液在Ag+催化下将Mn2+氧化为MnO4-,本身转化为SO42-,则该反应的离子方程式为2Mn2++5S2O82-+8H2O═2MnO4-+10SO42-+16H+.若反应中有0.1mol还原剂参加反应,则消耗氧化剂的物质的量为0.25mol.
(3)过二硫酸钾可通过电解H2SO4和K2SO4的混合溶液制得,总反应为2H++2SO42-$\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑,其阳极反应方程式为2SO42--2e-=S2O82-.电解过程中,阳极产生微量氧化性极强的有色单质气体,该气体可能是O2(填化学式).电解过程中阴极附近溶液的pH将增大(填“增大”“减小”或“不变”).
(4)制得的产品可用碘量法测定其纯度.称取0.2500g产品于碘量瓶中,加30mL 水溶解:加入4.000g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉溶液为指示剂,用c mol/L Na2S2O标准液滴定至终点,消耗Na2S2O溶液VmL,计算样品中K2S2O8的纯度为54cV%(用含c、V的代数式表示).(已知:S2O82-+2I-=2SO42-+I2; 2S2O32-+I2=2I-+S4O62-)
分析 (1)过氧化氢是共价化合物,氧原子和氢原子间形成极性共价键,据此书写电子式;根据结构简式为 判断氧元素的化合价;
判断氧元素的化合价;
(2)Mn由+2价升到+7价,S由+7降到+6,根据得失电子守恒书写配平离子方程式;根据书写的离子方程式结合化合价降低为氧化剂,升高为还原剂分析计算;
(3)电解池中阳极为失电子发生氧化反应;阴极为得电子发生还原反应,据此分析解答;
(4)淀粉与碘单质作用显蓝色,根据碘原子守恒找出K2S2O8与碘单质的关系式分析计算.
解答 解:(1)过氧化氢是共价化合物,氧原子和氢原子间形成极性共价键,则H2O2的电子式为 ;因为过二硫酸的结构简式为
;因为过二硫酸的结构简式为 ,其中含有过氧根,则氧元素的化合价为-1、-2,故答案为:
,其中含有过氧根,则氧元素的化合价为-1、-2,故答案为: ;-1、-2;
;-1、-2;
(2)Mn由+2价升到+7价,S由+7降到+6,根据得失电子守恒配平反应,再由电荷守恒确定出产物中有H+,最后由H原子守恒,确定反应物中还有H2O,则离子方程式为:2Mn2++5S2O82-+8H2O═2MnO4-+10SO42-+16H+;其中氧化剂是S2O82-,还原剂是Mn2+,若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为0.25mol,故答案为:2Mn2++5S2O82-+8H2O═2MnO4-+10SO42-+16H+;0.25;
(3)由电解总反应为2H++2SO42-$\frac{\underline{\;电解\;}}{\;}$S2O82-+H2↑,阳极为失电子发生氧化反应,则反应式为:2SO42--2e-=S2O82-;依据电解原理可知,氢氧根离子也可能失去电子生成氧气单质,故氧化性较强的单质为O2;阴极H+放电,水的电离平衡正向移动,c(OH-)增大,所以pH增大,
故答案为:2SO42--2e-=S2O82-;O2;增大;
(4)K2S2O8具有强氧化性可以将I-氧化为I2,1molK2S2O8得到2mol电子生成1mol碘,淀粉与碘单质作用显蓝色,所以指示剂选择淀粉溶液,I2+2S2O32-=2I-+S4O62-,则
K2S2O8~I2 ~2S2O32-
1mol 2mol
n(K2S2O8) cmol/L×0.001VL
解得:n(K2S2O8)=5×10-4 cVmol,m(K2S2O8)=n×M=5×10-4 cVmol×270g/mol=0.135cVg,
该产品 中K2S2O8的质量分数为$\frac{0.135cVg}{0.2500g}$×100%=54cV%,
故答案为:淀粉溶液;54cV%.
点评 本题考查了有关硫的化合物的知识,侧重于电解原理和工业生产的综合运用,题目难度中等,注意正确书写电极反应式理顺 K2S2O8~I2 ~2S2O32-关系为解答该题的关键,根据电子守恒进行计算.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | W的简单阴离子半径一定大于Z的简单阳离子半径 | |
| B. | 最简单氢化物的稳定性:X-定强于Y | |
| C. | Y单质分子的电子式-定为 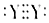 | |
| D. | X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中 |
| A. | 12 g石墨中含有C-C键的个数为3NA | |
| B. | 7.8g Na2O2晶体中含有阴阳离子总数为0.4NA | |
| C. | 1 mol SiO2晶体中含有4NASi-O键 | |
| D. | 1.4 g乙烯(C2H4)和丙烯(C3H6)的混合物中含碳氢键数为0.1 NA |
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 熔融状态下能导电的物质一定是离子化合物 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 完全由非金属元素形成的化合物中可能含有离子键 |

| A. | 图①可以表示在绝热容器中放入N2和H2,在催化合成氮的过程中,N2的转化率随时间的变化曲线 | |
| B. | 图②可以表示在T℃的密闭容器中,反应2AgBr(s)?2Ag(s)+Br2(g)达到平衡,此时再开始增大容器的体积,最终容器中仍有AgBr(s)剩余时容器内压强的变化曲线 | |
| C. | 图③可以表示等体积等pH的碳酸钠溶液和醋酸钠溶液加水稀释过程中pH的变化趋势 | |
| D. | 图④可以表示氯化银和溴化银饱和溶液等体积混合后,再向该混合溶液中加入浓AgNO3溶液时,生成沉淀的物质的量随加入AgNO3溶液体积的变化曲线 |
 化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
化学上常用AG表示溶液中的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.25℃时,用0.100mol•L-1的NaOH溶液滴定20.00mL 0.100mol•L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A. | D点溶液的pH=11.25 | |
| B. | B点溶液中存在 c(H+ )-c(OH- )=c(NO2- )-c(HNO2) | |
| C. | C点时,加入NaOH溶液的体积为20 mL | |
| D. | 25℃时,HNO2的电离常数Ka=1.0×10-55 |
| 实验操作 | 实验现象 | 实验目的 | |
| A | 向待测液中滴加盐酸和稀硝酸 | 产生白色沉淀 | 检验待测液中是否含有Ag+ |
| B | 将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末 | 淡黄色粉末变白 | 除去CO2,提纯CO |
| C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 证明氯的非金属性比硫的强 |
| D | 在Ag2S浊液中滴加NaCl溶液 | 产生白色沉淀 | 比较Ag2S和AgCl的溶解度大小 |
| A. | A | B. | B | C. | C | D. | D |

| A. | X与Z形成的某种化合物可用来杀菌消毒 | |
| B. | C极易溶于B中,溶液呈碱性 | |
| C. | Y与Z形成的二元化合物只含有极性键 | |
| D. | A和C能发生氧化还原反应 |
| A. | K>Ca>Ga | B. | Li>Na>K | C. | S>P>Al | D. | H>N>Ne |