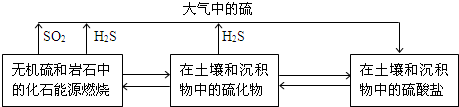
题目内容
 氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.(1)N原子价电子轨道表示式
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同.PCl5晶体类型是
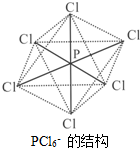
(3)PCl6-呈正八面体的结构(如图),该离子中
(4)NCl3分子中,N原子杂化方式是
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是
考点:原子核外电子排布,共价键的形成及共价键的主要类型,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)氮原子价电子层上有5个电子,2s轨道上有2个电子,2p有3个电子,依据价电子轨道表示方法进行解答;
(2)PCl5晶体由PCl4+和PCl6-构成,属于离子晶体;根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断空间构型;
(3)P原子只有5个价电子,PCl6-呈正八面体的结构,P原子形成了6个共价键,有一个配位键;
(4)根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4,故N原子采取SP3杂化;共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(5)C失去第四个电子时达到全满,电离第五个电子最不容易; 故第五电离能最大,O失去5个电子时达到半满,N失去4个电子时还有一个孤电子,所以失去第五个电子N比O容易.
(2)PCl5晶体由PCl4+和PCl6-构成,属于离子晶体;根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数,据此判断空间构型;
(3)P原子只有5个价电子,PCl6-呈正八面体的结构,P原子形成了6个共价键,有一个配位键;
(4)根据价电子对互斥理论确定微粒的空间构型,NCl3中N原子成3个N-Cl键,还有1对孤对电子,杂化轨道数是4,故N原子采取SP3杂化;共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(5)C失去第四个电子时达到全满,电离第五个电子最不容易; 故第五电离能最大,O失去5个电子时达到半满,N失去4个电子时还有一个孤电子,所以失去第五个电子N比O容易.
解答:
解:(1)氮原子价电子层上有5个电子,2s轨道上有2个电子,2p有3个电子,分别在不同的轨道上且自旋方向相同,其价电子的轨道表示式为 ,故答案为:
,故答案为: ;
;
(2)由题中信息可知,PCl5在固态时由PCl4+和PCl6-两种离子构成,属于离子晶体,PCl4+的含有4个σ键且不含孤电子对,所以其采用sp3杂化,空间构型是正四面体,
故答案为:离子晶体;正四面体;
(3)P原子的原子序数为15,基态氮原子的价电子排布式是1s22s22p63s23p3,只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键,
故答案为:是;P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;
(4)NCl3中N原子成3个N-Cl键,孤电子对个数=
=1,价层电子对个数=σ键个数+孤电子对个数=3+1=4,所以原子杂化方式是sp3,N原子的原子序数为6,基态氮原子的价电子排布式是1s22s22p3,氮气的结构式为N≡N,分子中含有1个σ键和2个π键,3Cl2分子中含有3个σ键,所以分解过程中形成σ键和π键数目之比为2:1,
故答案为:sp3;2:1;
(5)电离能和粒子半径以及是不是稳定状态有关,C原子价电子层上有4个电子,失去第四个电子时达到全满,电离第五个电子最不容易要破坏稳定状态,第五电离能(I5)最大,N失去五个电子刚好达到稳定状态,第五电离能(I5)最小,O原子价电子层上有6个电子,O失去5个电子时达到半满,相对要容易,所以C、N、O三种元素的第五电离能(I5)由大到小顺序是:C>O>N,
故答案为:C>O>N.
 ,故答案为:
,故答案为: ;
;(2)由题中信息可知,PCl5在固态时由PCl4+和PCl6-两种离子构成,属于离子晶体,PCl4+的含有4个σ键且不含孤电子对,所以其采用sp3杂化,空间构型是正四面体,
故答案为:离子晶体;正四面体;
(3)P原子的原子序数为15,基态氮原子的价电子排布式是1s22s22p63s23p3,只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键,
故答案为:是;P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;
(4)NCl3中N原子成3个N-Cl键,孤电子对个数=
| 5-3×1 |
| 2 |
故答案为:sp3;2:1;
(5)电离能和粒子半径以及是不是稳定状态有关,C原子价电子层上有4个电子,失去第四个电子时达到全满,电离第五个电子最不容易要破坏稳定状态,第五电离能(I5)最大,N失去五个电子刚好达到稳定状态,第五电离能(I5)最小,O原子价电子层上有6个电子,O失去5个电子时达到半满,相对要容易,所以C、N、O三种元素的第五电离能(I5)由大到小顺序是:C>O>N,
故答案为:C>O>N.
点评:本题考查了物质结构及其性质,涉及原子杂化方式的判断、价电子排布式的书写、元素周期律等知识点,根据价层电子对互斥理论、构造原理等知识来分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
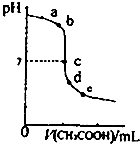 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
下列说法中正确的是( )
| A、布朗运动就是液体分子的热运动 |
| B、对一定质量的气体加热,其内能一定增加 |
| C、物体的温度越高,分子热运动越剧烈,分子的平均动能越大 |
| D、分子间的引力与斥力同时存在,斥力总是小于引力 |
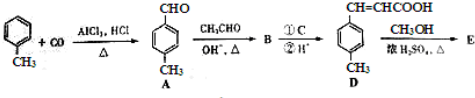
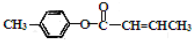 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为