题目内容
3.同一温度下,甲溶液的pH是3,乙溶液的pH是5,甲溶液与乙溶液的c(OH-)之比为( )| A. | 3:5 | B. | 5:3 | C. | 100:1 | D. | 1:100 |
分析 pH=-lgc(H+),甲溶液的pH是3,c(H+)=1×10-3mol/L,乙溶液的pH是5,c(H+)=1×10-5mol/L,根据Kw=c(H+)×c(OH-),计算c(OH-),再比较.
解答 解:pH=-lgc(H+),甲溶液的pH是3,c(H+)=1×10-3mol/L,根据Kw=c(H+)×c(OH-),c(OH-)=$\frac{{K}_{w}}{1×1{0}^{-3}}$mol/L,
乙溶液的pH是5,c(H+)=1×10-5ol/L,根据Kw=c(H+)×c(OH-),c(OH-)=$\frac{{K}_{w}}{1×1{0}^{-5}}$mol/L,则甲溶液与乙溶液的c(OH-)之比为:$\frac{{K}_{w}}{1×1{0}^{-3}}$:$\frac{{K}_{w}}{1×1{0}^{-5}}$=1:100,
故选D.
点评 本题考查了pH的简单计算,明确氢离子与氢氧根离子浓度的关系是解本题的关键,题目难度不大.

练习册系列答案
相关题目
14.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
| A. | 气体A的平衡转化率大于气体B平衡转化率 | |
| B. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数减小 | |
| C. | 物质D的聚集状态一定是气体 | |
| D. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 |
11.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅.下列有关硅及其化合物叙述正确的是( )
| A. | 水玻璃做防火材料 | B. | 二氧化硅不和任何酸反应 | ||
| C. | 可用石英坩埚加热氢氧化钠固体 | D. | 光导纤维的主要成分是硅 |
18.天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li 被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为CoO2+LiC6 $?_{充电}^{放电}$LiCoO2+C6,下列说法正确的是( )
| A. | 充电时,电池的阳极反应为LiC6-e=Li++C6 | |
| B. | 放电时,电池的正极反应为 CoO2+Li++e-=LiCoO2 | |
| C. | 乙酸、乙醇等含活泼氢的有机物可做该锂离子电池的电解质 | |
| D. | 该锂离子电池的比能量(消耗单位质量电极所释放的电量)比铅蓄电池低 |
8.氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2kJ,则Q2>2Q1(填“>”、“<”或“=”)
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如表:请完成下列问题.
①试比较K1.K2的大小,K1>K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正> v(N2)逆(填写“>”.“=”或“<”)
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2kJ,则Q2>2Q1(填“>”、“<”或“=”)
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如表:请完成下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正> v(N2)逆(填写“>”.“=”或“<”)
15.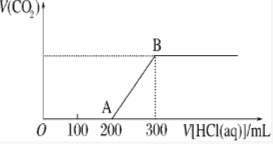 将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )
将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )
 将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )
将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
12.丙烯是一种重要的化工原料、燃料,下列有关丙烯及聚丙烯的说法正确的是( )
| A. | 丙烯与等物质的量氯化氢加成只生成一种产物 | |
| B. | 1mol丙烯完全燃烧的耗氧量为4.5mol | |
| C. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| D. | 1mol丙烯和1mol聚丙烯完全燃烧放出CO2的量相同 |
13.有8种物质:①甲烷②苯③聚乙烯④氯乙烯⑤2-丁炔⑥环己烷⑦邻二甲苯⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色又能与溴水起加成反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |