题目内容
18.下列叙述中正确的是( )| A. | 卤族元素是典型的非金属元素,因此不能与其他非金属元素反应 | |
| B. | 碱金属元素单质越活泼,其熔点和沸点就越高 | |
| C. | 卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强 | |
| D. | 卤族元素单质都能与水剧烈反应 |
分析 A.卤族元素性质较活泼,易和氢气等物质反应;
B.碱金属族元素,其单质的活泼性随着原子序数增大而增强,其熔沸点随着原子序数增大而减小;
C.元素的非金属性越强,其氢化物的稳定性越强,其单质的氧化性越强;
D.卤族元素单质较活泼,能和水反应.
解答 解:A.卤族元素最外层有7个单质,所以性质较活泼,易和氢气等非金属发生反应,故A错误;
B.碱金属族最外层只有一个电子,易失电子,其金属性随着原子序数增大而增强,所以其单质的活泼性随着原子序数增大而增强,但其熔沸点随着原子序数增大而减小,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,其单质的氧化性越强,所以其气态氢化物的稳定性随单质氧化性的增强而增强,故C正确;
D.卤族元素单质较活泼,能和水反应,但只有氟气和水反应剧烈,故D错误;
故选C.
点评 本题考查金属性和非金属性性质递变规律,为高频考点,明确金属性、非金属性与得失电子能力、氢化物的稳定性之间的关系是解本题关键,金属性、非金属性与得失电子难易程度有关,与得失电子多少无关.

练习册系列答案
相关题目
9.下列有机物的命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 3-甲基-2-乙基戊烷 | ||
| C. | 1,1-二氯乙烯 | D. | 2,3-二甲基-2-戊烯 |
6.已知:①H+(aq)+OH-(aq)═H2O(l);△H1;②2SO2(g)+O2(g)?2SO3(g);△H2.其他条件不变时,改变反应物的量,则下列判断正确的是( )
| A. | △H1,△H2都不变 | B. | △H1,△H2都增大 | C. | △H1,△H2都减小 | D. | 不能确定 |
13.已知硅在自然界中有3种同位素:${\;}_{14}^{28}Si$、${\;}_{14}^{29}$Si、${\;}_{14}^{30}Si$.硅的近似相对原子质量为28.1,则${\;}_{14}^{28}Si$原子在自然界中的百分含量为( )
| A. | 等于90% | B. | 大于90% | C. | 小于90% | D. | 无法判断 |
10.表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是A.
A.H2B.Cl2 C.Br2 D.I2
(2)相同条件下,X2 (X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2.
(3)已知拆开1mol H-H键、1mol N-H键、1molN≡N 键分别需要吸收的能量为436kJ、391k J、946k J.则由氢气和氮气反应生成1mol NH3需要放出(填“放出”或“吸收”)92 k J的热量.
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A.
A.H2B.Cl2 C.Br2 D.I2
(2)相同条件下,X2 (X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是Cl2.
(3)已知拆开1mol H-H键、1mol N-H键、1molN≡N 键分别需要吸收的能量为436kJ、391k J、946k J.则由氢气和氮气反应生成1mol NH3需要放出(填“放出”或“吸收”)92 k J的热量.
7.下列说法中,不正确的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、丙三醇都是无色溶于水的有机化合物 |
8.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图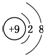 | ||
| C. | 次氯酸电子式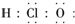 | D. | 用电子式表示HCl形成过程 |
 H2O
H2O C2H4
C2H4 .
.