题目内容
用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol?L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol?L-1(小数点后保留两位有效数字).
(2)判断滴定终点的现象是 .
(3)以下操作可能造成测定结果偏高的是 (填写序号).
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
(2)判断滴定终点的现象是
(3)以下操作可能造成测定结果偏高的是
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗碱式滴定管.
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:(1)先判断数据的合理性,然后NaOH溶液的平均体积,然后根据HCl~NaOH求盐酸的物质的量浓度;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色;
(3)根据c(待)=
分析不当操作对V(标)的影响,以此判断浓度的误差.
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色;
(3)根据c(待)=
| c(标)×V(标) |
| V(待) |
解答:
解:(1)四次消耗的NaOH溶液的体积为18.30mL,18.10mL,20.20mL,18.20mL,第三组数据舍去,三次滴定盐酸溶液的平均体积为18.20mL
HCl~NaOH
1 1
C(HCl)×25.00mL 0.20mol?L-1×18.20mL
解得:C(HCl)=0.1456mol?L-1=0.15mol?L-1;
故答案为:0.15;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色,
故答案为:溶液的颜色由无色变为浅红色且30s不变色;
(3)A.等质量的氢氧化钠与碳酸钠与盐酸反应,前者消耗的盐酸多,所以配制标准溶液的氢氧化钠中混有Na2CO3杂质,造成V(标)偏大,根据c(待)=
分析,可知c(待)偏大,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,造成V(标)偏小,根据c(待)=
分析,可知c(待)偏小,故B错误;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标)偏大,根据c(待)=
分析,可知c(待)偏大,故C正确;
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗,对V(标)无影响,根据c(待)=
分析,可知c(待)不变,故D错误;
E.未用标准液润洗碱式滴定管,标准液浓度降低,造成V(标)偏大,根据c(待)=
分析,可知c(待)偏大,故E正确;
故选ACE.
HCl~NaOH
1 1
C(HCl)×25.00mL 0.20mol?L-1×18.20mL
解得:C(HCl)=0.1456mol?L-1=0.15mol?L-1;
故答案为:0.15;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色,
故答案为:溶液的颜色由无色变为浅红色且30s不变色;
(3)A.等质量的氢氧化钠与碳酸钠与盐酸反应,前者消耗的盐酸多,所以配制标准溶液的氢氧化钠中混有Na2CO3杂质,造成V(标)偏大,根据c(待)=
| c(标)×V(标) |
| V(待) |
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,造成V(标)偏小,根据c(待)=
| c(标)×V(标) |
| V(待) |
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标)偏大,根据c(待)=
| c(标)×V(标) |
| V(待) |
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗,对V(标)无影响,根据c(待)=
| c(标)×V(标) |
| V(待) |
E.未用标准液润洗碱式滴定管,标准液浓度降低,造成V(标)偏大,根据c(待)=
| c(标)×V(标) |
| V(待) |
故选ACE.
点评:本题主要考查酸碱滴定计算及基本操作,比较基础,侧重考查学生对实验数据的分析处理能力,难度不大.

练习册系列答案
相关题目
下列装置或操作能达到实验目的是( )
A、 检查装置气密性 |
B、 从碘的CCl4溶液中分离出碘 |
C、 除去甲烷中乙烯 |
D、 分离甲苯与乙醇 |
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 甲 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A、A | B、B | C、C | D、D |
常温下,下列有关说法中不正确的是( )
| A、amol?L-元酸HA溶液与bmol?L-1NaOH溶液等体积混合后,若pH为7,则c(A-)=c(Na+) |
| B、在Kw/c(H+)=0.1mol?L-l的溶液中,Na+、K+、CO32-、NO3-能大量共存 |
| C、将等浓度等体积的Na2CO3溶液、CH3COONa溶液、NaOH溶液稀释相同倍数,pH变化最大的是CH3COONa溶液 |
| D、25℃时氢氧化钠滴定二元弱酸H2R水溶液,得到含有H2R、HR-、R2-三种微粒的溶液,当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为NaHR |
 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )| A、A→F,△H=-△H6 |
| B、△H1+△H 2+△H 3+△H 4+△H 5+△H6=1 |
| C、C→F,|△H|=|△H 1+△H 2+△H 6| |
| D、△H1+△H2+△H 3=-△H 4-△H5-△H 6 |
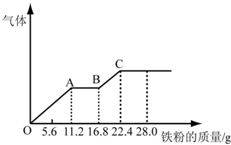 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.