题目内容
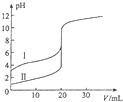 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20ml时,C(Cl-)=C(CH3COO-) |
| D、V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO- )>C(H+)>C(OH- ) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸;
B.pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸的体积稍微大于NaOH;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断;
B.pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸的体积稍微大于NaOH;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断;
解答:
解:A.醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸,所以I是滴定醋酸的曲线,故A错误;
B.NaOH和醋酸恰好反应时生成强碱弱酸盐,醋酸钠溶液呈碱性,pH=7时,溶液呈中性,要使溶液呈中性,则醋酸的体积稍微大于NaOH,所以滴定醋酸消耗的V(NaOH)小于20mL,故B正确;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解,所以c(Cl-)>c(CH3COO-),故C错误;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故D错误;
故选B.
B.NaOH和醋酸恰好反应时生成强碱弱酸盐,醋酸钠溶液呈碱性,pH=7时,溶液呈中性,要使溶液呈中性,则醋酸的体积稍微大于NaOH,所以滴定醋酸消耗的V(NaOH)小于20mL,故B正确;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解,所以c(Cl-)>c(CH3COO-),故C错误;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故D错误;
故选B.
点评:本题考查了酸碱混合溶液定性判断,涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度中等.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
在0.1mol?L-1氨水中加入少量的NH4Cl晶体,则溶液的pH( )
| A、变大 | B、变小 |
| C、不变 | D、无法确定 |
下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ?mol-1).
下列关于元素R的判断中一定正确的是( )
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 | … |
| A、R的最高正价为+3价 |
| B、R元素位于元素周期表中第ⅡA族 |
| C、R元素的原子最外层共有4个电子 |
| D、R元素基态原子的电子排布式为1s22s22p1 |
下列氧化物中,不会产生酸雨的是( )
| A、CO2 |
| B、NO |
| C、NO2 |
| D、SO2 |
在一定条件下,使 CO 和 O2的混合气体22g充分反应,所得混合物在常温下跟足量Na2O2 固体反应,结果固体增重14g,则原混合气体中O2 和CO的质量比是( )
| A、1:2 | B、3:8 |
| C、5:6 | D、4:7 |