题目内容
钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 .
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为 .
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是 ,构成丙烯腈元素中第一电离能最大的是 .
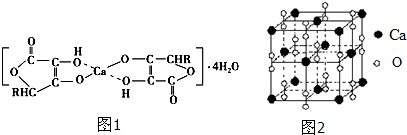
(2)抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如图1:化学选修:有机化学基础该物质中存在的化学键类型包括 (填字母).
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为 .已知阿伏加德罗常数为NA,该晶体的密度为ρg?cm3,则晶胞中两Ca2+间的最近距离为 cm.(用含NA、ρ的代数式表示)

(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是
(2)抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如图1:化学选修:有机化学基础该物质中存在的化学键类型包括
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为
考点:晶胞的计算,原子核外电子排布,位置结构性质的相互关系应用,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)①Cu为29号元素,Cu+的基态电子排布式为1s22s22p63s23p63d10;
②等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;
(2)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(3)黑色球为Ca、白色球为O,根据均摊法计算晶胞中钙离子与O22-的数目,根据晶胞密度可计算得晶胞的边长,晶胞中两Ca2+间的最近距离为晶胞面对角线的一半,据此答题;
②等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;
(2)非金属元素之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键;
(3)黑色球为Ca、白色球为O,根据均摊法计算晶胞中钙离子与O22-的数目,根据晶胞密度可计算得晶胞的边长,晶胞中两Ca2+间的最近距离为晶胞面对角线的一半,据此答题;
解答:
解:(1)①Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②根据等电子体原理可知,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
故答案为:2NA;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;构成丙烯腈的元素中,电负极性最小的是H,同一周期元素第一电离能从左到右逐渐增大,电离能最大的是N;
故答案为:sp、sp2;N;
(2)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,
故答案为:BCD;
(3)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
+1=4,钙离子占据顶点和面心,个数为8×
+6×
=4,个数比为1:1,则化学式为CaO2,设晶胞边长为a,根据ρ=
可得a=
cm,晶胞的对角线长度为
a,晶胞中两Ca2+间的最近距离为晶胞面对角线的一半,所以晶胞中两Ca2+间的最近距离为
,
故答案为:CaO2;
;
故答案为:1s22s22p63s23p63d10;
②根据等电子体原理可知,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,
故答案为:2NA;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;构成丙烯腈的元素中,电负极性最小的是H,同一周期元素第一电离能从左到右逐渐增大,电离能最大的是N;
故答案为:sp、sp2;N;
(2)非金属元素C、O,C、H之间形成共价键,金属离子与阴离子之间形成离子键,钙离子提供空轨道,O原子提供孤对电子,形成配位键,
故答案为:BCD;
(3)由晶体的晶胞结构图可知,O22-占据棱点和体心,个数为12×
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 3 |
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
故答案为:CaO2;
| ||
| 2 |
| 3 |
| ||
点评:本题是物质结构与性质综合题目,涉及电离能、核外电子排布、杂化理论与分子结构、晶胞计算等,难度中等,注意同周期中元素原子处于全满、半满稳定状态时,其第一电离能有较高异常现象.

练习册系列答案
相关题目
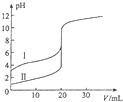 室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A、Ⅱ表示的是滴定醋酸的曲线 |
| B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| C、V(NaOH)=20ml时,C(Cl-)=C(CH3COO-) |
| D、V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO- )>C(H+)>C(OH- ) |
甲、乙、丙都是金属单质,当电解甲离子和丙离子的混合盐溶液时,丙先析出,当甲与乙组成原电池时,甲为电池的正极,甲、乙、丙三种金属的活动性顺序为( )
| A、甲>乙>丙 |
| B、乙>甲>丙 |
| C、乙>丙>甲 |
| D、丙>乙>甲 |
以石墨作电极电解下列溶液,电解后加入括号内的物质不能使电解质溶液恢复原状的是( )
| A、CuCl2溶液(CuCl2) |
| B、CuSO4溶液(CuO) |
| C、NaCl溶液(HCl) |
| D、KNO3溶液(KNO3) |
下列各组溶液,只用试管和胶头滴管,而不用其他试剂就可以鉴别的是( )
| A、NaOH溶液和Al2(SO4)3溶液 |
| B、稀硫酸和NaHCO3溶液 |
| C、CaCl2溶液和Na2CO3溶液 |
| D、Ba(OH)2溶液和NaHSO4溶液 |
下列式子属于水解反应,且溶液呈酸性是( )
| A、HCO3-+H2O?H3O++CO32- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、HS-+H2O?H2S+OH- |
| D、HCOOH+H2O?HCOO-+H3O+ |
下列现象或事实可用同一化学原理解释的是( )
| A、氯气和二氧化硫使品红溶液褪色 |
| B、常温下,可以用铝制容器贮藏浓硫酸和浓硝酸 |
| C、浓硫酸和浓盐酸暴露在空气中浓度均减小 |
| D、氯化铵和碘都可以用加热法进行提纯 |